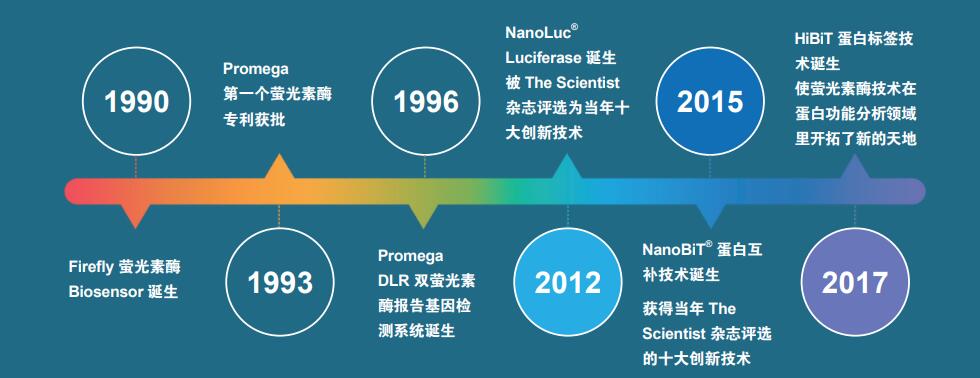
自1990年萤光素酶生物传感器技术诞生以来,单萤光素酶检测系统到双萤光素酶检测系统的发展,为科研人员提供了更为严谨的实验手段。
双萤光素酶报告基因检测系统在单报告基因的基础上引入了“内参对照”报告基因,可以排除不同组之间细胞生长状况、细胞数目以及转染效率带来的干扰,起到校正的作用,从而使实验结果更为可靠。
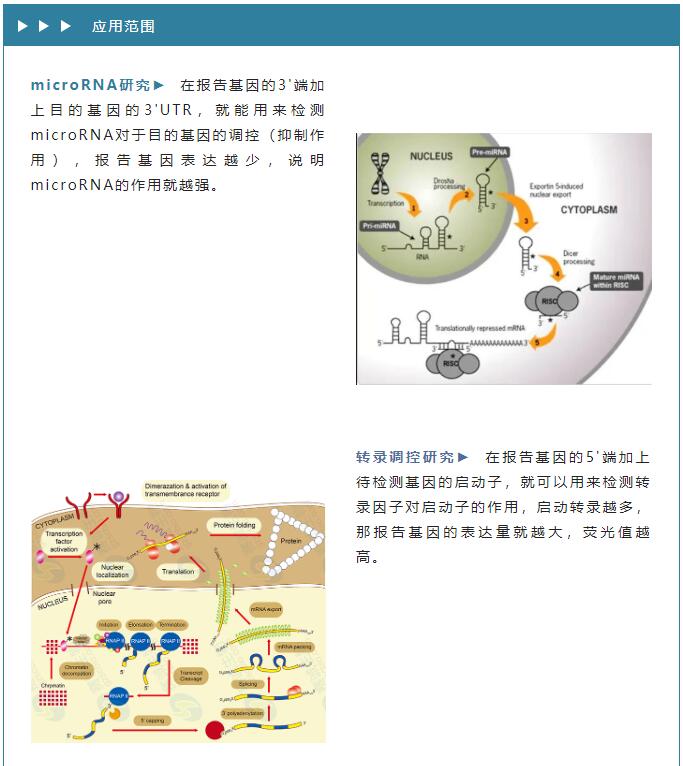
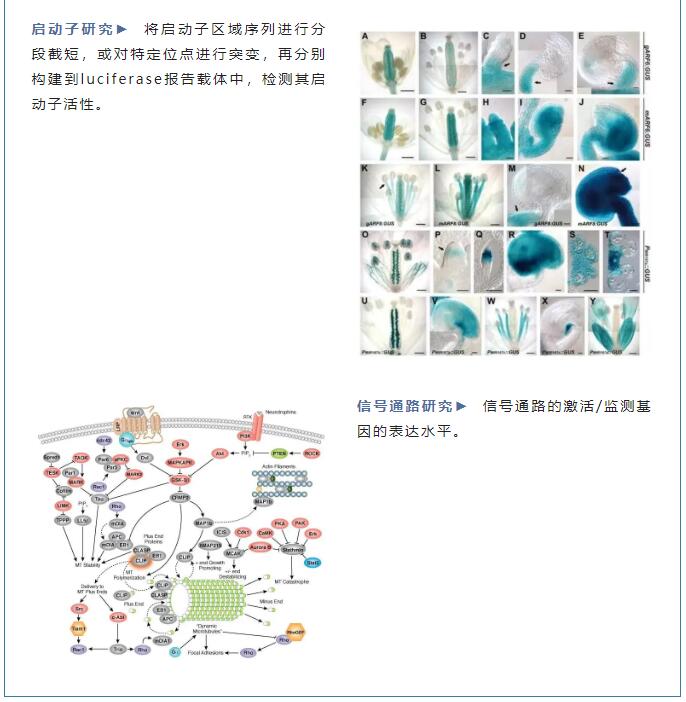
检测原理
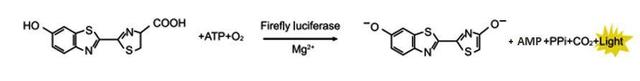
萤火虫萤光素酶是一种胞内蛋白,大小为61KDa。在氧气、ATP和镁离子同时存在的条件下,催化底物萤火虫萤光素氧化,生成氧化萤光素,并发出黄绿色光,其最强发光波长为560nm。
海肾萤光素酶也是一种胞内蛋白,大小为36KDa。只需要氧气就可以催化腔肠素,氧化生成高能产物coelenteramide,并发出蓝光,其最强发光波长为465nm。
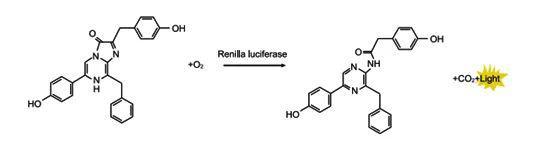
对于发光反应,全透明板会有明显的相邻孔之间的信号干扰,使测量结果产生误差。
为此常规实验操作流程中先在普通的透明细胞培养板中培养细胞,加入检测试剂待细胞裂解后把样品转移到全白检测板中进行检测。但此操作复杂且容易使样本损失。
如何隔绝信号的同时
减少样本损失?
选耐思全新材质细胞培养板!
耐思384孔白色细胞培养板全新升级!材质大提升,我们研发出最适合的全光谱光反射率的材料,让每一个培养孔独自美丽,隔绝相邻孔的信号。

在同种光源照射下,由新材质制成白色细胞培养板,呈现出更为优越的避光性能。
同时新增96孔白色细胞培养板,助力多样化实验需求。
为客户提供更优质的实验室耗材,让实验更轻松,让数据更准确!


那么在双荧光素酶检测中应该如何使用96孔白色培养板呢?
质粒转染细胞
1、细胞铺板:将细胞按70%的汇合度接种到96孔板。
2、转染:16小时后转染萤光素酶报告基因质粒和RNA,每个样品设置6个复孔。
1) 配制DNA和转染试剂: 96孔板转染质粒时每孔比例Firefly:Renilla:转染试剂=0.1μg:0.01μg:0.25μL;
2) 配制RNA和转染试剂稀释液,RNA的终浓度为100nM,转染试剂每孔0.25μL;
3) 稀释好的DNA和RNA及转染试剂,常温孵育5min;
4) 将稀释好的DNA和RNA分别和转染试剂混匀,常温孵育20min;
5) 每孔弃去50μL 培养基,将25μL DNA转染混合液和25μL RNA转 染混合液分别添加到每孔细胞样品中;
6) 转染6小时后,换新鲜完全培养基。
双报告基因检测
1、质粒共转染48小时后,弃去培养基,用100μL1XPBS洗1遍;
2、 倾斜96孔板,吸干剩余的PBS;
3、去离子水将5XPLB稀释成1XPLB,使用前放到常温;
4、每孔加50μl稀释好的1XPLB,摇床常温条件下摇15min,进行裂解;
5、加入预先混好的LAR II,2s后测数据;
6、每孔添加100μL预先混好的Stop&Glo Reagent,静止2s后,测数据。
耐思,为你成为实验大神保驾护航!
