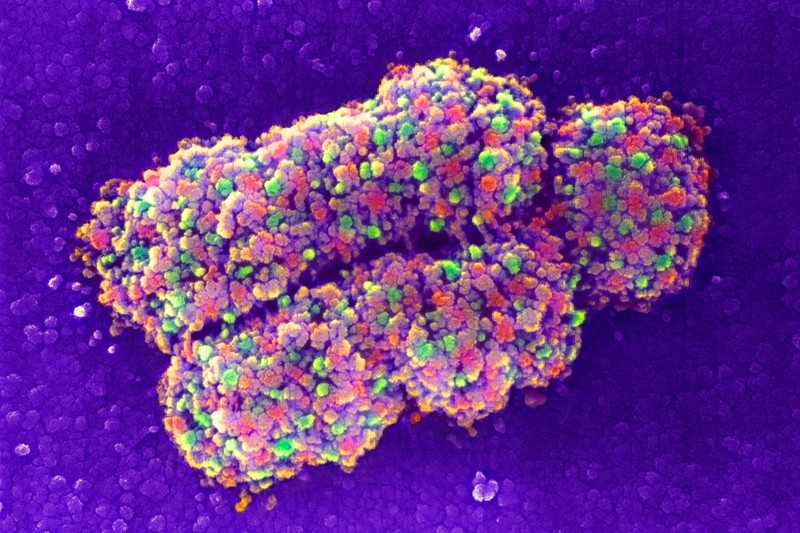
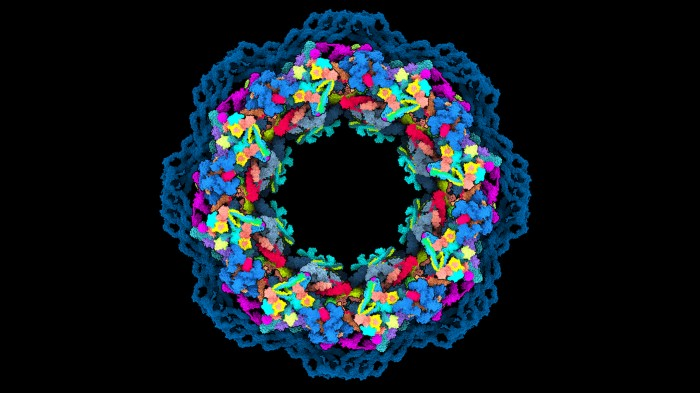
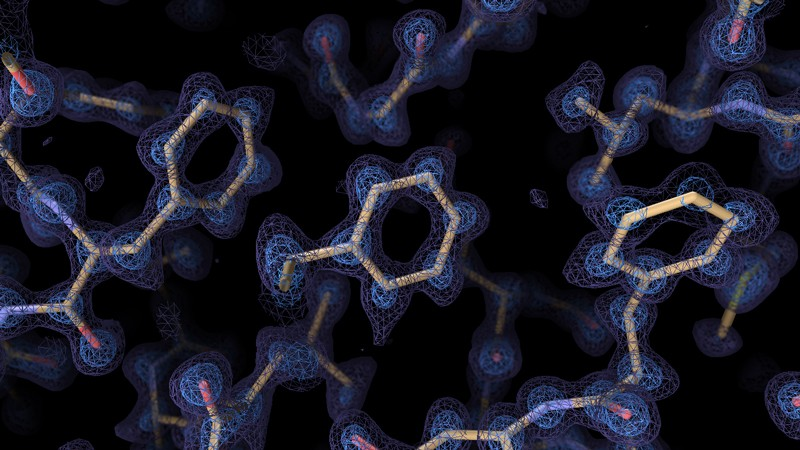
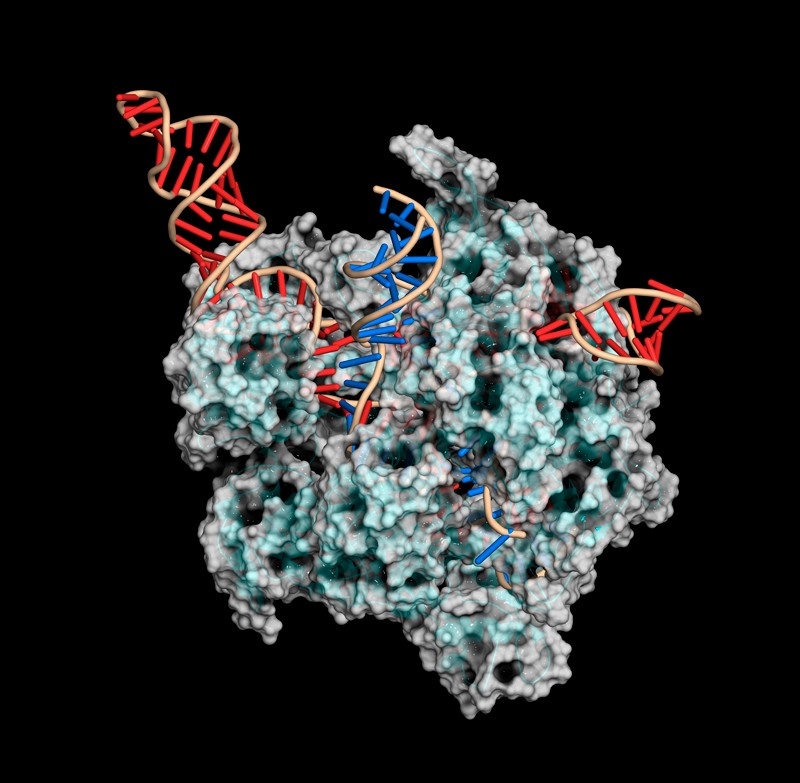
从基因编辑到蛋白质结构测定再到量子计算,他们是未来一年可能对科学领域产生影响的七项技术。 一、完整测序的人类基因组 当加利福尼亚大学圣克鲁兹分校的基因组学研究人员Karen Miga和马里兰州贝塞斯达国家人类基因组研究所的Adam Phillippy在2019年启动“端粒到端粒”(Telomere to Telomere consortium,T2T)联盟时,大约十分之一的人类基因组仍然未知。 现在,这个数字已降至为零。 在去年5月发表的预印本中,该联盟公布了人类基因组的第一个端到端序列,从一个端粒(覆盖染色体末端的重复序列元件)延伸到另一个端粒的基因组图谱,为广泛使用的人类共有基因组序列GRCh38增加了近2亿个新碱基对,撰写了人类基因组计划的最后一章。 “端粒到端粒”联盟正在对整个染色体进行测序。 图片来源:Adrian T. Sumner/SPL 二、蛋白质结构解决方案 蛋白质的结构决定了它的功能,但其结构很难解析。近两年的重大实验和计算进步为研究人员提供了两种可以以前所未有的速度和分辨率确定蛋白质结构的补充工具。 由Alphabet在伦敦的子公司DeepMind开发的AlphaFold2结构预测算法,通过“深度学习”从氨基酸序列中推断出折叠蛋白质的形状。在2020年蛋白质结构预测技术的关键测试(CASP)中,计算生物学家直接测试了他们的结构预测算法,在此竞赛中取得决定性胜利后,AlphaFold2的声誉和采用率皆飙升。自去年7月公开发布以来,AlphaFold2已被应用于蛋白质组学,以确定在人类和20种模式生物中表达的所有蛋白质,以及Swiss-Prot数据库中的近44万种蛋白质的结构,大大增加了可获得高可信度建模数据的蛋白质的数量。AlphaFold算法也证明了其处理多链蛋白质复合物的能力。 与此同时,低温电子显微镜(cryo-EM)的改进使研究人员能够通过实验解决即使是最具挑战性的蛋白质和复合物。Cryo-EM使用电子束扫描快速冷冻的分子,生成多个方向的蛋白质图像,然后通过计算重新组装成3D结构。2020年,cryo-EM硬件和软件的改进使科学家能够以分辨率低于1.5埃的结构捕获单个原子的位置。 许多最初对AlphaFold2持怀疑态度的实验者现在将其视为对低温电镜等实验方法的补充,其计算模型可以帮助数据分析和重建。而低温电镜可以生成目前无法通过计算预测的实验结果。 人类核孔复合物的模型,使用AlphaFold2和结构数据构建。图片来源:Agnieszka Obarska-Kosinska 来自低温电子显微镜的图像有助于解决复杂的结构。 图片来源:Paul Emsley/MRC Laboratory of Molecular Biology 三、量子模拟 原子在适当的条件下,可以被诱导进入高度激发的超大尺寸状态,直径约为一微米或更大。物理学家已经证明,通过激发数百个原子列,他们可以解决传统计算机所不能解决的物理问题。 量子计算机以量子比特的形式管理数据。量子比特由称为纠缠的量子物理现象耦合在一起,可以在一定距离内相互影响。相对于经典计算机中同等数量的比特,量子比特可以极大地提高计算能力。 物理学家使用光学镊子将不带电的原子精确定位在紧密排列的2D和3D阵列中,然后使用激光将这些粒子激发成大直径的“Rydberg原子”,并与相邻原子纠缠在一起。Rydberg原子系统是单独可控的,它们的相互作用可以打开和关闭,这反过来又赋予了它们可编程性。 该领域的先驱者已经成立了一些公司,这些公司正在开发基于Rydberg原子阵列的系统供实验室使用。这项工作也可以为量子计算机在经济、物流和加密等领域的广泛应用铺平道路。 四、精确的基因组编辑 就其基因组编辑能力而言,CRISPR-Cas9技术更适合基因失活而不是基因修复。这是因为尽管Cas9酶能相对精确地靶向基因组序列,但由DNA双链断裂引发的非同源末端连接(NHEJ)的细胞修复经常因微小的插入或缺失而变得混乱。 哈佛大学化学生物学家David Liu指出,大多数遗传疾病需要基因修正而不是基因破坏。Liu和他的团队已经开发出两种方法来做到这一点,两者都利用了CRISPR的精确靶向定位,同时也限制了Cas9酶在该位点切割DNA的能力。第一种方法被称为碱基编辑(Base editing),将催化受损的Cas9与一种酶结合,该酶可以帮助一种核苷酸化学转化为另一种核苷酸——例如,胞嘧啶转化为胸腺嘧啶或腺嘌呤转化为鸟嘌呤。另一种方法被称为先导编辑(Prime editing),是该团队新开发的技术,将Cas9与一种称为逆转录酶的酶结合,并使用一种经过修饰的向导RNA,以包含对目标基因组序列的所需编辑。通过多阶段生化过程,它们将向导RNA复制到目标DNA中,最终取代目标基因组序列。重要的是,Base editing和Prime editing都只切割一条DNA链,这对细胞来说是一种更安全、破坏性更小的过程。 Base editing在2016年首次出现在科学论文中,现已进入临床阶段:由Liu创立,总部位于剑桥的Beam Therapeutics于11月获得美国FDA的批准,首次在人体内试验这种方法,以修复导致镰状细胞病的基因。 CRISPR-Cas9基因编辑复合物使用向导RNA(红色)切割目标DNA(蓝色)。 图片来源:Mulekuul/SPL 五、靶向基因治疗 基于核酸的药物可应用于临床,但它们可应用于的组织范围仍然受到很大限制。大多数疗法需要局部给药,或从患者身上采集细胞、进行离体操作、然后移植回患者体内。肝脏是其中一个例外,这一过滤血液的器官是特异性药物递送的一个主要靶点。静脉输注、甚至皮下注射都可以达到肝脏特异性递送的效果。 腺相关病毒是许多基因治疗的首选载体,动物研究表明,仔细选择合适的病毒与组织特异性基因启动子相结合,可以有效地将药物地送到特定的器官系统,同时不影响其他非靶组织。然而,病毒有时难以大规模生产,并且会引发过度免疫反应,从而破坏疗效或产生不良反应。 脂质纳米颗粒是一种非病毒替代策略,过去几年发表的几项研究强调了可调整其特异性的潜力。 六、空间多组学 随着单细胞组学领域的爆炸式发展,现在研究人员可以常规地从单个细胞中获得遗传学、转录组学、表观遗传学和蛋白质组学的信息——有时甚至是同时进行的。但是单细胞技术也会因为细胞从其原生环境中被剥离出来而损失关键信息。 2016年,由斯德哥尔摩KTH皇家理工学院的Joakim Lundeberg领导的研究团队设计出一种载玻片,装载了带条形码的寡核苷酸(RNA或DNA的短链),可以从完整的组织切片中捕获信使RNA,这样每个转录物就可以根据其条形码被分配到样本中的特定位置。此后,空间转录组学领域的研究呈爆炸式增长。现已有多种商业系统可用。学术团体继续开发创新方法,以不断增加的深度和空间分辨率绘制基因表达图谱。 现在,研究人员正在他们的空间地图之上进一步分层“组学见解”。例如,康涅狄格州纽黑文耶鲁大学的生物医学工程师范荣开发了一个名为 DBiT-seq 16的平台,它采用了一种微流体系统,可以同时为数千个 mRNA 转录物和数百个用寡核苷酸标记的抗体标记的蛋白质生成条形码。与仅从转录组数据中获得的数据相比,这可以更准确地评估细胞基因表达如何影响蛋白质的产生和活性,范的团队一直在使用它来研究免疫细胞激活等过程。“我们正在看到皮肤中的免疫细胞如何对 Moderna COVID-19 疫苗作出反应的早期迹象,”他说。一些商业系统还可以从多种蛋白质中获取空间数据,同时获取转录组学见解,包括 Visium 平台和 Nanostring 的 GeoMx 系统。 七、基于CRISPR的诊断 CRISPR-Cas系统能够精确切割特定核酸序列,这项功能源于其作为细菌“免疫系统”在对抗病毒感染时产生的作用。科学家因此考虑该系统是否适用于病毒诊断。 Cas9是基于CRISPR的基因组操作的首选酶,但基于CRISPR的诊断大部分都使用了称为Cas13的RNA靶向分子家族,该家族于2016年由麻省理工学院-哈佛大学布罗德研究所分子生物学家张锋及其团队首次发现。Cas13使用向导RNA通过碱基配对识别靶标RNA并激活核糖核酸酶活性,通过使用报告RNA,此过程可用作一种诊断工具。这是因为Cas13不仅可以切割向导RNA靶向的RNA,它还对附近的任何其他RNA分子进行“附带切割”。许多基于Cas13的检测方法使用一种报告RNA,该RNA将荧光标签连接到抑制该荧光的猝灭剂分子上。当Cas13在识别病毒RNA后被激活时,它会切割报告基因并从猝灭剂中释放荧光标签,从而产生可检测的信号。一些病毒留下了足够强的特征,检测可以在不放大的情况下进行,从而简化了即时诊断。 RNA扩增程序可以提高对微量病毒序列检测的灵敏度,布罗德研究所的遗传学家Pardis Sabeti和她的同事开发了一种微流体系统,该系统使用仅来自几微升样本的扩增遗传物质并行筛选多种病原体。她说:“现在,我们有一种检测方法可以同时检测21种病毒,而每份样本的成本不到10美元。” 文献来源: Nature 601, 658-661 (2022) doi: https://doi.org/10.1038/d41586-022-00163-x