基因表达调控是生物体内基因表达的调节控制,在疾病研究领域,基因表达调控几乎是所有生物学过程的基础。细胞水平上对目的基因的导入方式根据基因调控的时间长短可分为瞬时转染和稳定转染,实验中多会选择稳转的方式构建稳定表达细胞株,避免瞬转效率不同以及瞬转细胞传代过程中目的基因丢失等原因对实验造成误差。
01
稳定细胞株的构建方法
稳定转染原理:特定基因或干扰特定基因的序列整合至宿主的基因组染色体中,不会随着细胞的增殖分裂而消失,在宿主细胞中可以稳定表达目的序列。通常,人们借助慢病毒能够整合序列到宿主基因组的能力来完成基因的稳定表达或稳定干扰。
构建稳定株步骤如下(以Saos-2细胞为例):
1) 细胞铺板
将Saos-2细胞按30%汇合度接种到6孔板:
① Saos-2细胞配成2.0×105cells/mL细胞悬液,待铺板。
② 每孔铺2mL,即4×105cells/well,铺1个6孔板。
2) 感染慢病毒
细胞铺板后12-20h感染病毒
① 加病毒量计算方法:(细胞数×MOI值/病毒原液滴度)×103=病毒用量(μL)
②加polybrene:细胞样品中polybrene终浓度为5μg/mL。
③ 病毒感染12-20h后换培养基:弃去培养基,每孔加入2mL新鲜的培养基。
3) 稳定株筛选
① 72h以后,加入终浓度2μg/mL puromycin。每隔2-3d换一次终浓度2μg/mL puromycin新鲜培养基。
② 药物筛选约两周后,拍荧光照片。
③ 稳定细胞株鉴定和冻存。
注:其他细胞的polybrene浓度及抗生素浓度需要做预实验进行确定。
02
不同基因调控策略的选择
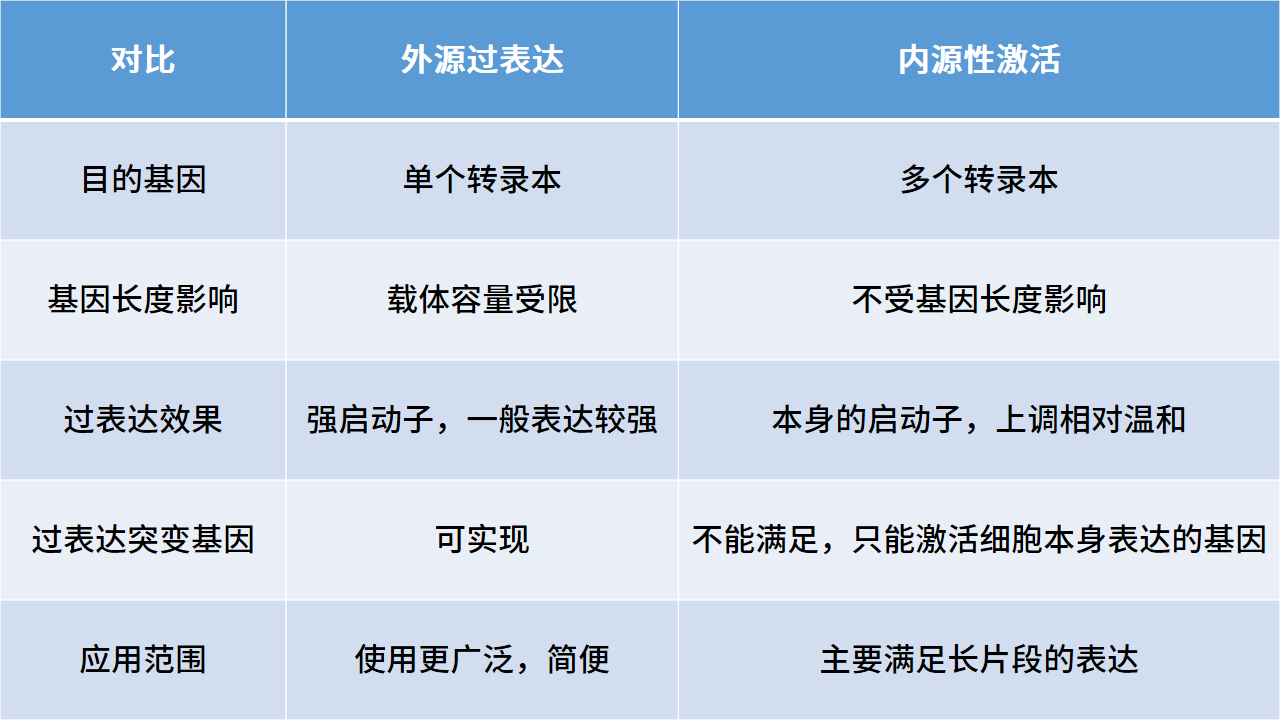
基因表达的调控可在多个层面上进行,包括基因水平、转录水平、转录后水平、翻译水平和翻译后水平的调控,我们日常提及的基因调控多指基因及转录水平的上调和下调。基因的上调又可分为外源过表达和内源性激活CRISPRa(如表一),当目的基因序列过长,载体容量受限时多会选择内源性激活的方式实现目的基因上调。CRISPRa是利用CRISPR/Cas9系统,突变Cas9蛋白切割DNA的活性位点,使Cas9蛋白丧失切割DNA功能但依然保留与DNA结合的能力——称之为“d-Cas9”,d-Cas9连接激活元件(VP64)通过gRNA引导至目的基因的转录起始位点,便可实现目的基因的转录激活。
表一:外源过表达与内源性激活的区别
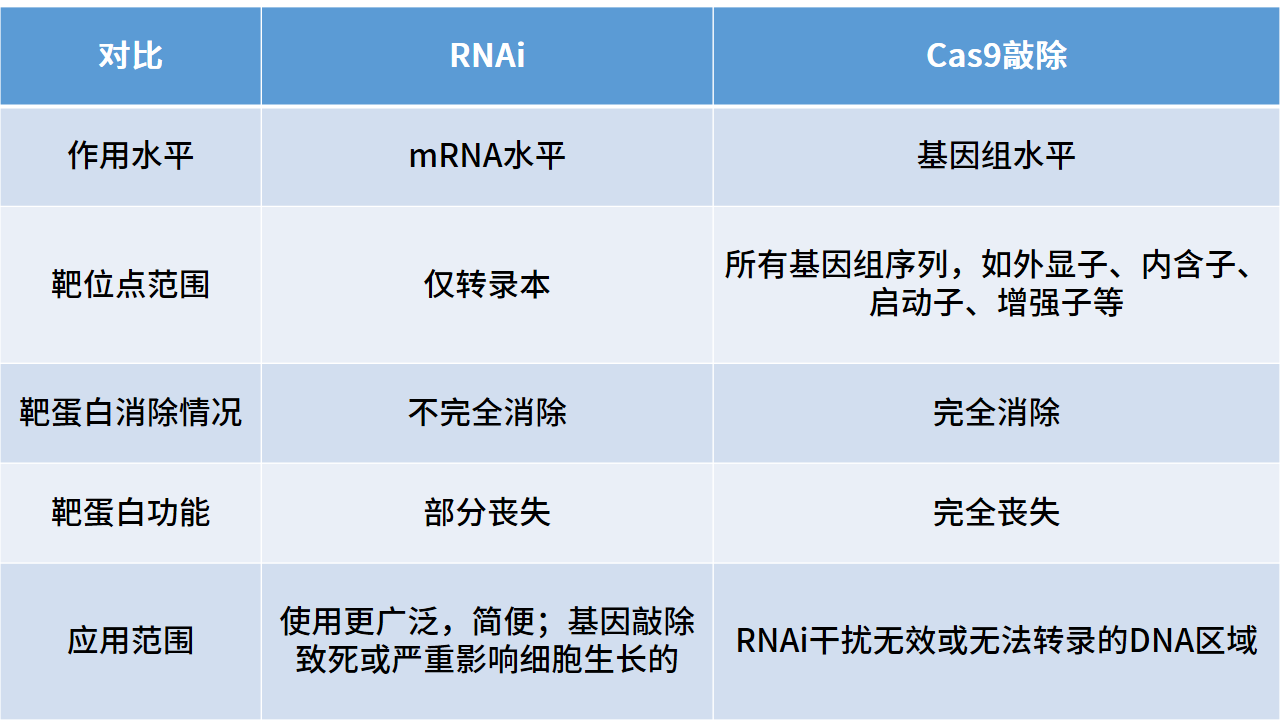
基因的下调一般都会采用RNA干扰(RNAi)技术,利用双链RNA(dsRNA)高效、特异性降解细胞内同源mRNA从而阻断靶基因表达。但RNAi技术对靶基因的消除是不完全的,若想完全消除需要借助CRISPR/Cas9技术实现基因的敲除,可根据实验需求选择RNAi或是基因敲除(如表二)。
表二:基因沉默两种方式比较
基因下调也可以选择内源性抑制CRISPRi策略,与CRISPRa的原理相似,“d-Cas9”与基因抑制结构域(KRAB结构域)融合表达,通过gRNA的引导可实现目的基因的转录抑制。CRISPRi策略的优势在于可以不改变内源基因组序列、有较高水平的基因抑制效果、特异性更强且适用编码或非编码等多种类型的基因。
选择合适的基因调控策略,借助慢病毒载体整合基因的能力,快来构建稳转株吧!小编精心整理了和元客户应用不同调控基因策略的研究成果,以期为科研人er提供新的研究思路!
03
和元客户案例分享
1) 过表达&干扰
文章标题:Hypoxia-induced circRNF13 promotes the progression and glycolysis of pancreatic cancer
研究内容:糖酵解(胰腺癌)
发表期刊:Exp Mol Med. IF:12.153
细胞类型:SW-1990(过表达circRNF13)/MIA PaCa-2(干扰circRNF13)
载体信息:pGLV31H1-Luci-circRNF13-OE/LV-shcircRNF13/LV-NC
克隆形成实验检测稳定过表达或稳定敲低circRNF13会正向调控PC细胞增殖(图A-D)。稳定细胞株构建肿瘤异种移植模型来验证circRNF13在体内的作用。结果显示,circRNF13过表达显著加速肿瘤生长,肿瘤体积和最终肿瘤重量显著增加(图E-H),而circRNF13敲低组的肿瘤体积和重量低于对照组(图I-L)。皮下肿瘤组织的免疫组织结果表明,Ki-67在circRNF13过表达肿瘤中的表达高于对照肿瘤(图M)。同时CD31(血管生成的生物标志物)阳性细胞在circRNF13过表达的肿瘤中的百分比高于对照肿瘤(图M)。在circRNF13敲低的肿瘤中的结果与之相反。为了进一步确定circRNF13在PC血管生成中的功能,过表达circRNF13 SW-1990细胞的条件培养基增加了人脐静脉内皮细胞(HUVECs)的管形成。相应地,敲低circRNF13 MIA PaCa-2细胞的条件培养基在很大程度上损害了血管生成能力(图N)。综上所述, circRNF13在PC增殖和血管生成中起重要作用。
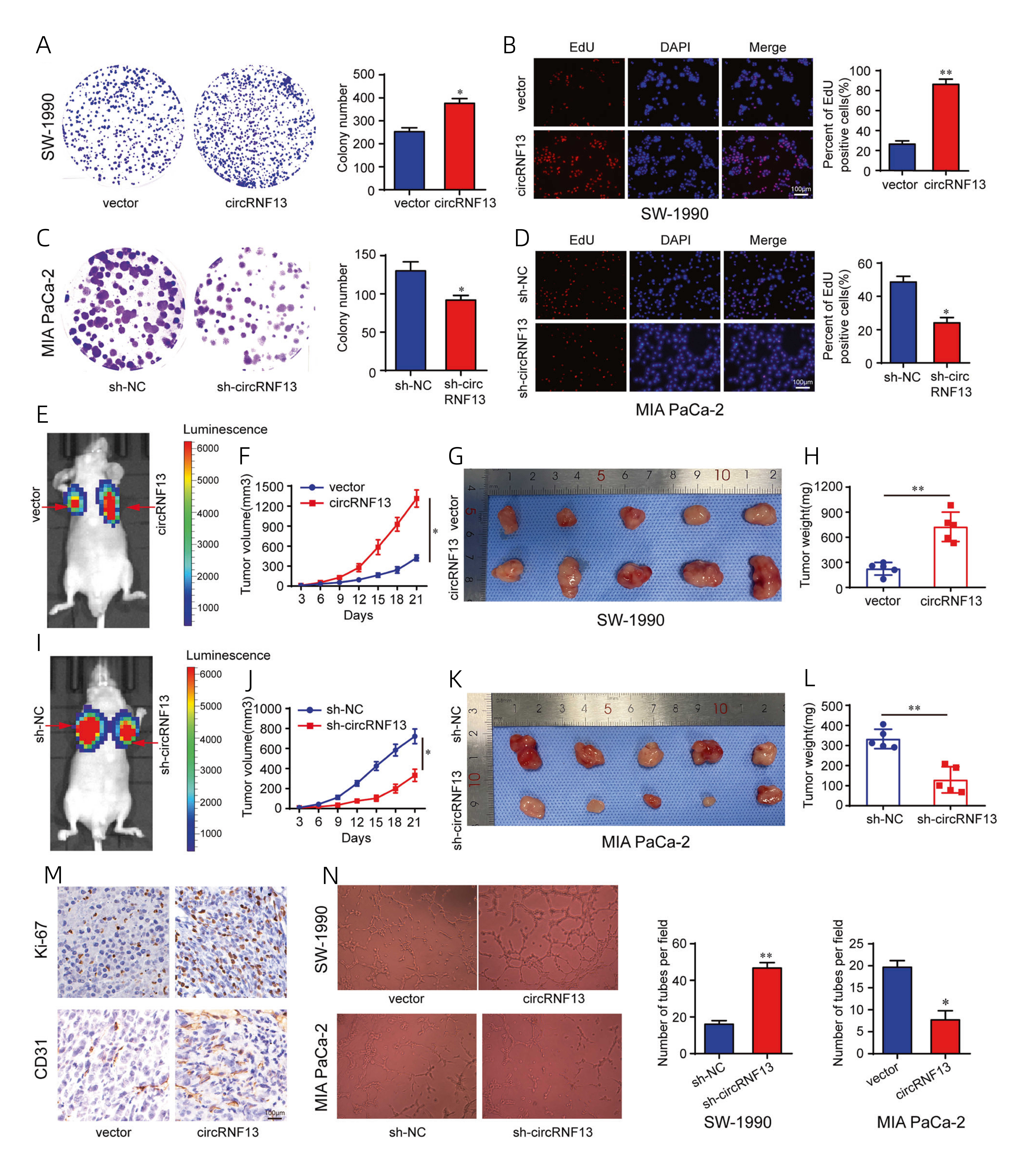
图1. CircRNF13在体外和体内促进PC增殖和血管生成
2) 内源性激活
文章标题:PTENα and PTENβ promote carcinogenesis through WDR5 and H3K4 trimethylation
研究内容:肿瘤发生机制
发表期刊:Nat Cell Biol. IF:28.231
细胞类型:293T(内源性激活USP9X)
载体信息:LV-dCas9-Puro,LV-gRNA(USP9X/WDR5/PTEN3/PTENα/β)
对50例肝癌患者的肿瘤组织和相应的癌旁组织进行免疫印迹检测,发现PTENα/β与PTEN蛋白在肝癌中的表达不一致。与癌旁组织相比,在一些PTEN减少的肿瘤组织中,PTENα/β的表达保持不变,甚至增加(图A,B)。PTENα和PTENβ对蛋白酶体介导的降解较PTEN更敏感。研究通过优化电泳策略分离PTENα和PTENβ,发现PTENα和PTENβ都比PTEN更不稳定(图C),蛋白酶体抑制剂MG132和PS341相较于溶酶体抑制剂NH4Cl或Brefeldin A显著积累了PTENα/β (图D)。Co-IP结合LC−MS/MS鉴定了3个E3连接酶或去泛素化酶(USP9X、USP7和TRIM28) 和PTENα相互作用的蛋白。通过干扰(shRNA)或敲除(CRISPR-Cas9)技术下调USP19在293T和Hela细胞中的表达会导致内源性PTENα/β的降低,而不影响PTEN的表达(图E-G)。相反的是,瞬时过表达USP9X和通过CRISPR-dCas9对USP9X进行的稳定转录激活均增加了293T细胞中的PTENα/β(图H,I),但未增加PTEN蛋白。综上,USP9X正向调节PTENα/β,但不调节PTEN蛋白的表达。
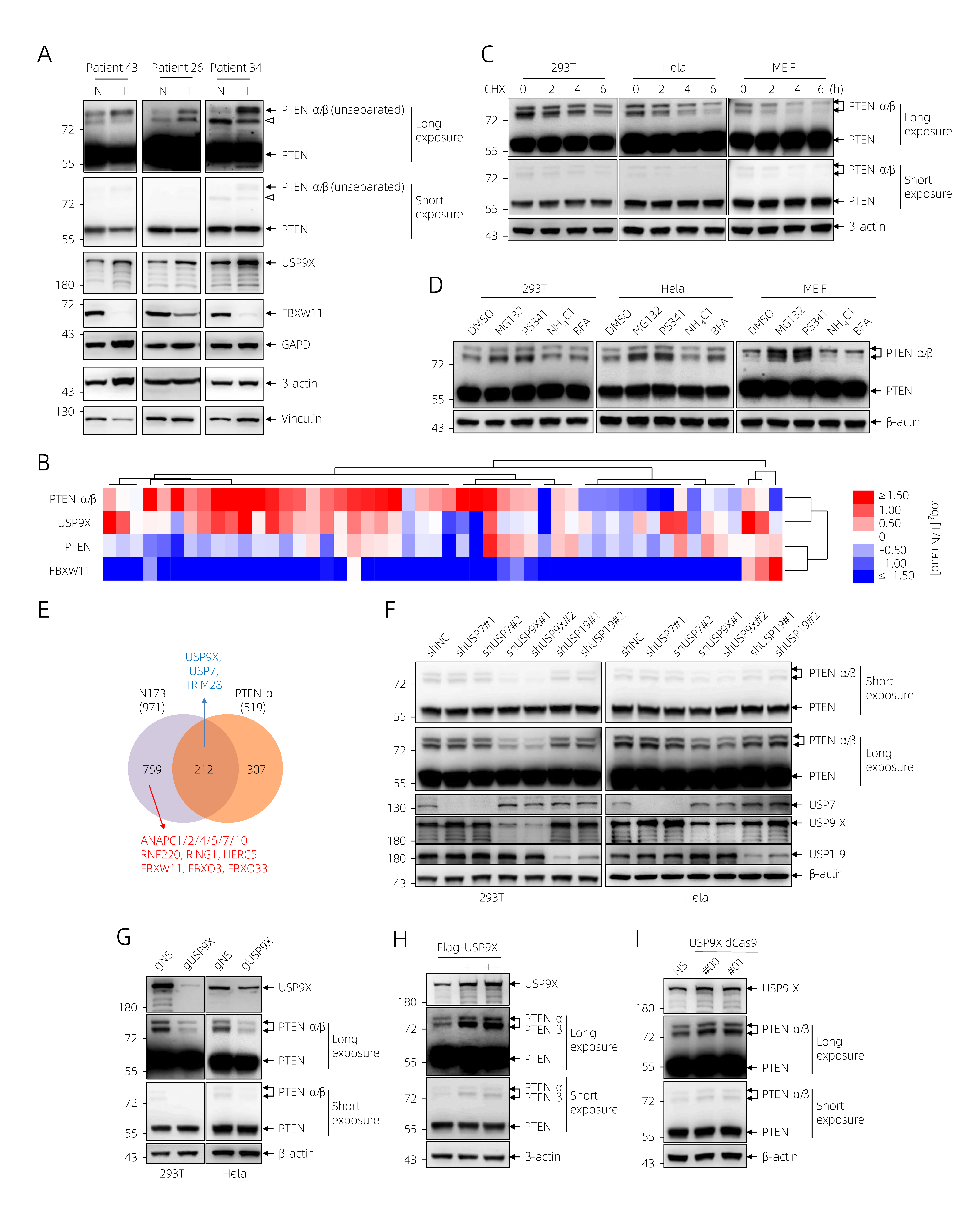
图2. PTENα和PTENβ在肝癌中的表达与PTEN蛋白不一致,且受USP9X的调控
3) 内源性抑制
文章标题:Human forebrain organoids-based multi-omics analyses reveal PCCB's regulation on GABAergic system contributing to schizophrenia
研究内容:精神分裂多组学分析
发表期刊:Research Square.
细胞类型:hiPSCs(内源性抑制PCCB)
载体信息:pLV-hU6-sgRNA-hUbC-dCas9-KRAB-T2a-Puro
PCCB编码丙酰辅酶a羧化酶的β亚基参与丙酰辅酶a28分解代谢的线粒体酶,PCCB突变可通过破坏三羧酸(TCA)循环来损害线粒体能量代谢。用PCCB稳定敲低的hiPSCs或对照hiPSCs产生的hFOs(Forebrain Organoid,大脑类器官)来研究敲低PCCB对功能的影响。结果显示,在细胞氧化磷酸化中起作用的几个线粒体基因MT-ND2、MT-ND5和MT-CYB,在PCCB-G1和PCCB-G2 hFOs中均下调(图A)。同时,PCCB敲低降低了hFOs中的ATP生成,增加了ROS水平(图B,C),引起线粒体功能障碍。ELISA实验证实PCCB敲低降低了琥珀酰辅酶a (SCOA)和α-KG(图D,E),当在hFOs的培养基中添加可转化为GABA的上游代谢物α-KG (10 μg/ml),发现在PCCB敲低的hFOs中GABA水平恢复(图F)。研究表明,PCCB敲低通过减少TCA循环降低GABA水平(图G)。
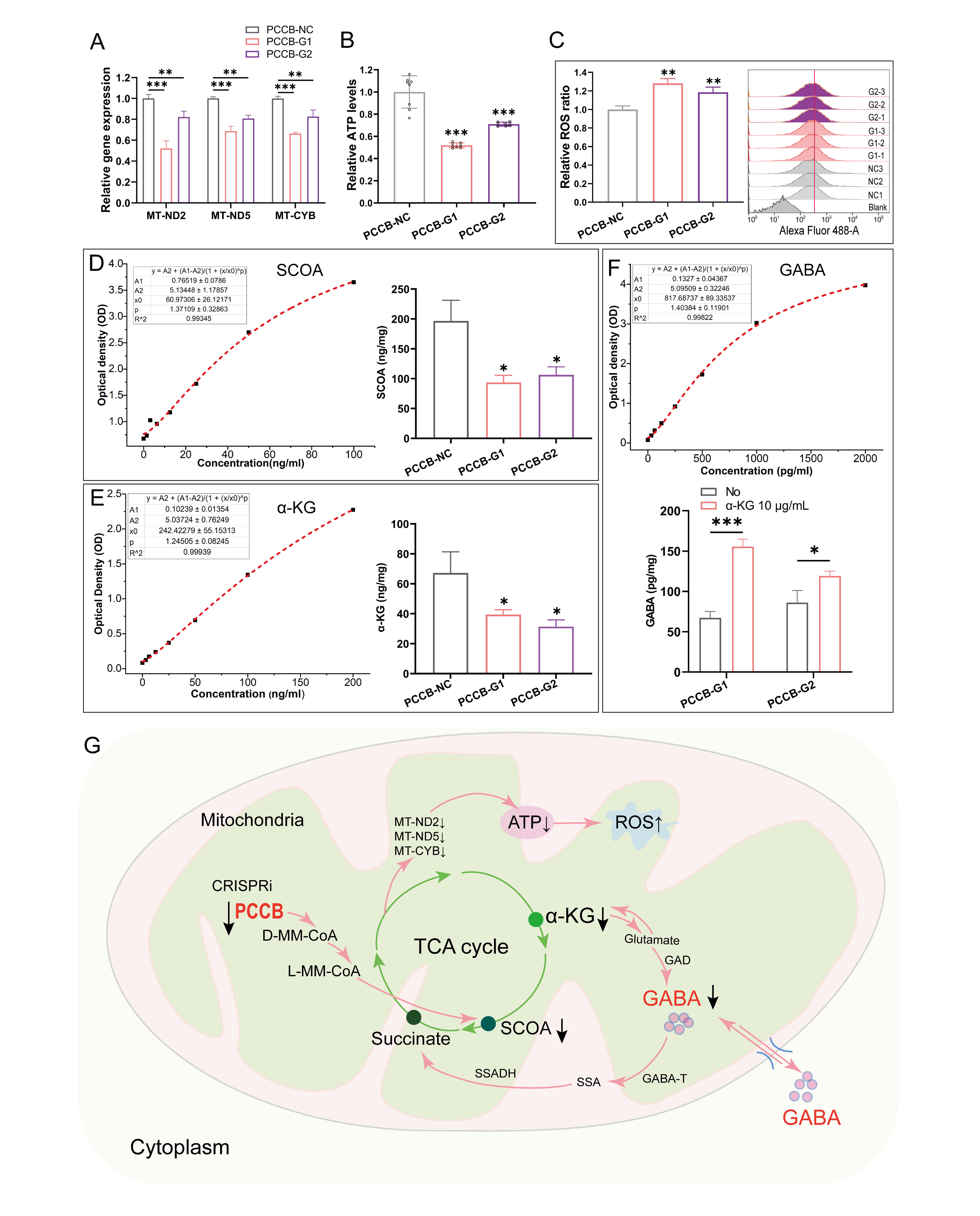
图3. 敲低PCCB导致hFOs线粒体功能障碍
4) 单克隆敲除
文章标题:FBXO22 promotes leukemogenesis by targeting BACH1 in MLL-rearranged acute myeloid leukemia
研究内容:白血病
发表期刊:J Hematol Oncol. IF:23.168
细胞类型:THP-1人单核细胞白血病细胞(敲除FBXO22)
载体信息:pLenti-U6-gRNA-mCMV-SaCas9-P2A-sfGFP(gFBXO22)
为了研究Fbxo22缺陷抑制AML进展的分子机制,通过免疫共沉淀(IP)结合LC-MS/MS分析探讨了Fbxo22在THP-1细胞中的相互作用。关注到氧化应激反应的调节因子BACH1为THP-1细胞中与FBXO22相互作用蛋白丰度最高的蛋白(图A)。在THP-1细胞中可以检测到内源性BACH1与FBXO22的相互作用(图B,C)。THP-1细胞用CRISPR/Cas9敲除FBXO22后构建单克隆株,发现BACH1的蛋白水平显著升高;shRNA敲低FBXO22使THP-1和MV4-11细胞中的BACH1稳定;并证实BACH1蛋白的增加与抑制BACH1的HO-1蛋白的减少相关(图D-F)。与此相反的是在THP-1细胞中,异位表达和诱导表达FBXO22显著降低BACH1蛋白和/或增加HO-1的表达(图G, H)。此外,放射线己酰亚胺(CHX)处理FBXO22敲除的THP-1细胞中BACH1蛋白的降低被显著阻断(图I)。进一步验证FBXO22是否通过蛋白酶体途径降解BACH1,显示,FBXO22的表达显著降低了BACH1蛋白的表达,而BFA和NH4Cl对该作用无明显影响,这表明FBXO22介导的BACH1降解受到蛋白酶体和CRL复合物调控(图L),并且FBXO22增加内源性BACH1蛋白的泛素结合物的丰度,反之FBXO22敲除降低了THP-1细胞内源性BACH1泛素化(图M,N)。这些结果表明,在MLLr AML细胞中,FBXO22与BACH1相互作用并促进BACH1的降解。
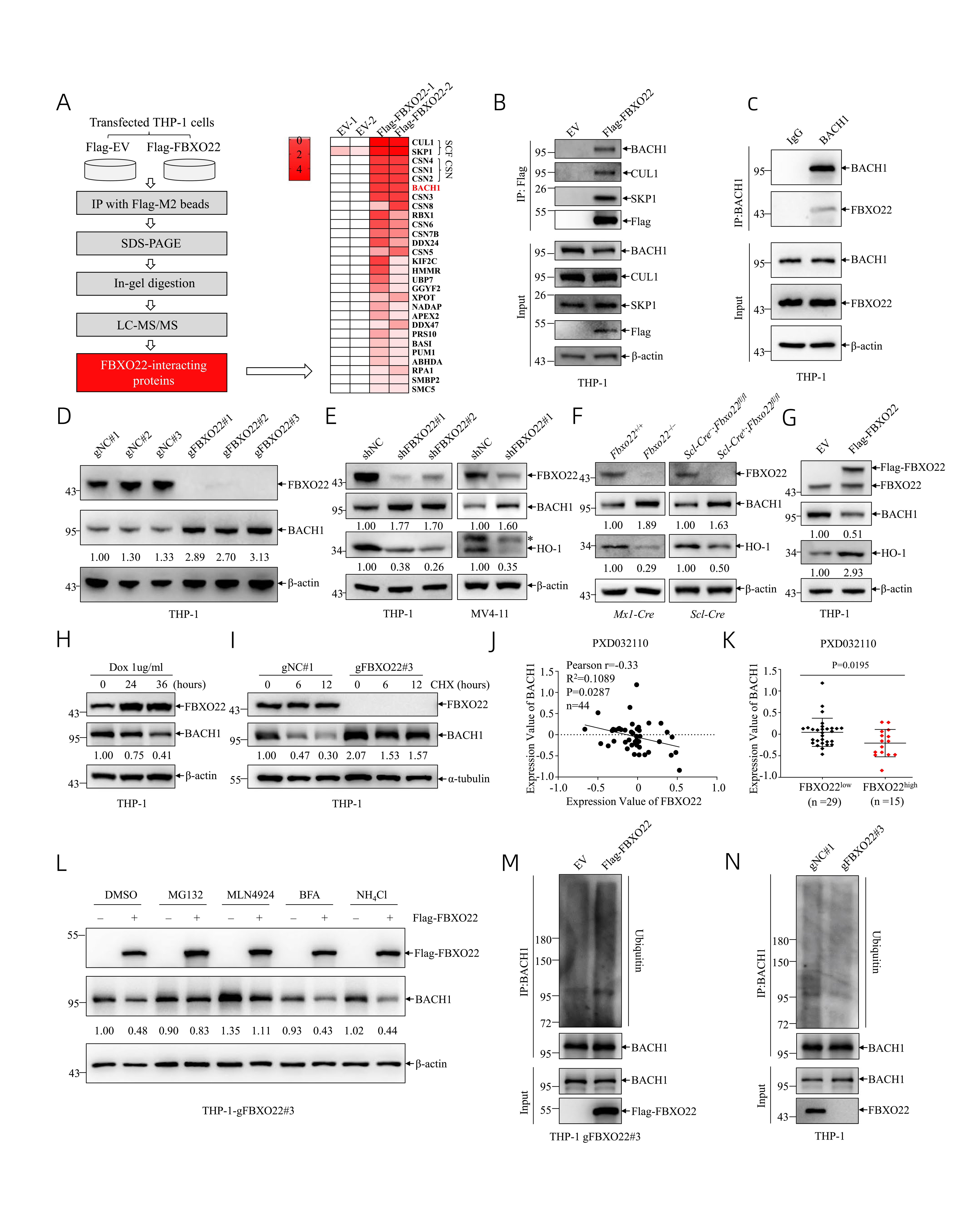
图4. FBXO22在MLLr AML细胞中促进BACH1的降解
和元生物有幸提供以上文章中所涉及的病毒包装服务。
和元生物拥有三质粒/四质粒多种慢病毒包装系统。涵盖过表达/干扰、CRISPR/Cas9、Cumate诱导表达系统、Tet-on/off系统、Cre-loxp系统等专属您的定制慢病毒,同时也涵盖CRISPR/Cas9敲除或激活文库、自噬单标或双标、萤光素酶现货慢病毒产品。
和元生物自主研发获批**的Vpack慢病毒包装系统,能够全面满足在科学研究中对基因调控的需求,解决病毒不出毒和滴度低的问题,能保证lncRNA表达更精确,载体荧光表达更亮,病毒出毒更稳定。
和元生物一直致力于病毒载体的研制服务,拥有10万+的病毒包装经验/4.6万+病毒载体库,包装GMP级别的病毒质粒。扫描下方二维码,获取更多应用细胞(细胞系、原代细胞、干细胞等)、类器官以及体内的基因调控(过表达、敲低、干扰等)经验。
业务咨询

