CHO细胞被广泛应用于重组医疗蛋白的生产,在其培养过程中,细胞分泌或释放一系列的宿主细胞蛋白(Host Cell Protein,HCP)。HCP是抗体生产过程中主要的杂质之一,它可能会诱发受体的免疫响应,产生抗药抗体(Anti-drug Antibody),从而影响药效;同时,部分蛋白酶和二硫还原酶催化降解产品,对其质量及稳定性产生负面影响。
面临的挑战:目前单克隆抗体生产工艺中,下游的亲和层析以及阴离子层析是去除HCP的主要工艺步骤;然而,HCP中的某些成分会与产品本身发生相互作用,导致其无法通过纯化去除并保留至最终产品中,同时,越来越高的HCP残留水平也给下游纯化工艺不断提出更高的挑战。
解决方案:目前已经有研究从基因序列、细胞系、细胞活率以及培养周期等角度对上游收获料液中HCP水平进行探讨,但总体上,文献报道仍然较少。在本研究中,通过在小试反应器工艺开发过程中的对比研究考察了两种不同的商品化补料对于上游反应器生产过程中细胞生长、代谢、蛋白表达和收获液中HCP水平的影响;并通过补料体积优化以及金属离子添加,尝试进一步降低HCP水平。
结果:
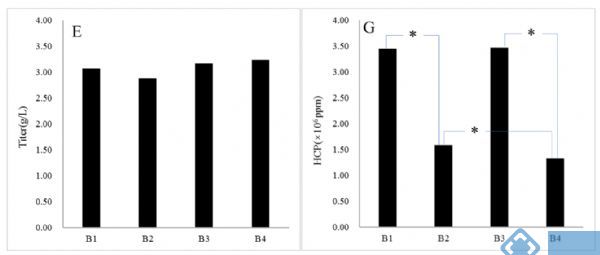
下图为4个3L反应器中的表达量和HCP的结果。4个条件下的表达量差异较小,但使用补料II的2个条件(B2和B4)中HCP水平明显低于使用补料I的2个条件(B1和B3)。(注:补料I为商品化补料培养基,包含两种成分;补料II为默克的Cellvento® 4Feed。)
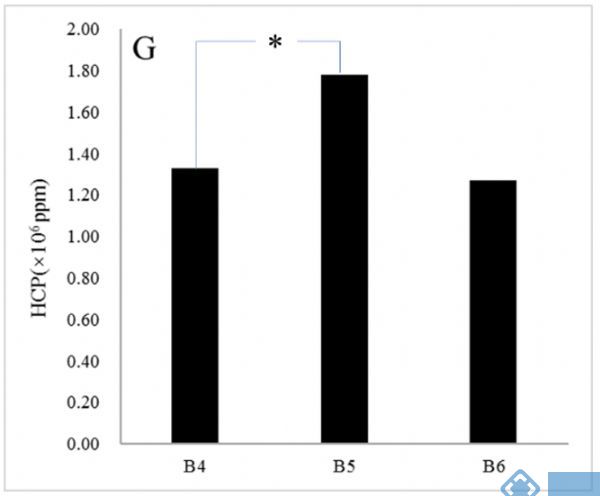
随后在B4基础上,进行了补料体积优化(B5)和金属离子的添加(B6);在添加了金属离子后,HCP得到了进一步的降低。
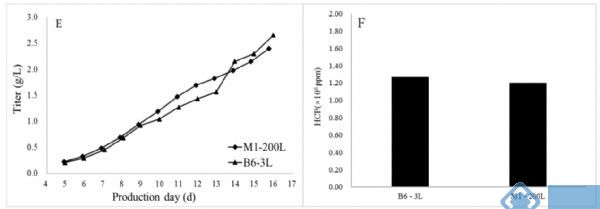
最终工艺被放大到200L的中试规模,并较好的重现了3L反应器中的结果:
了解更多,请点击此处!
默克上海BioReliance® E2E
生物工艺开发中心恢复全面运营
默克上海E2E生物工艺开发中心为全球客户与合作伙伴提供细胞株开发、工艺开发以及GMP临床样品生产服务。该中心计划在2020年完成产能扩建,提供2,000L的GMP临床样品生产服务。上海的E2E生物工艺开发中心是默克全球生物工艺开发中心网络的一部分,其他两个基地分别位于法国马蒂拉克和马萨诸塞州波士顿。

默克的BioReliance®
E2E解决方案提供最高质量水平的生物制药工艺开发和生产服务,其团队成员拥有30多年的工艺开发经验,已开发了超过260多种生物大分子项目。
为应对新冠疫情,默克采取了积极措施,确保员工安全和满足客户需求,并确保按时完成项目。默克BioReliance® E2E生物工艺开发亚太区总监陶菊红女士阐述了她的团队是如何积极应对和采取预防措施,在保证员工安全情况下,保持业务持续性的。
Q: 默克上海生物工艺开发中心是否已恢复全面运营?
A: 是的,已投入全面运营,我们正在进行多个全球客户有关治疗药物开发的新项目。为确保项目能够按时完成,我们密切关注全球供应的进展,并尽量通过默克产品的供应来确保供应的持续性。例如,如果客户与我们商谈细胞株开发项目,我们可选择默克自有的CHOZN®细胞株立即启动项目。在该情况下,我们的供应链可独立于其他供应商。
Q: 为确保生物开发中心在特殊时期能够保持运营,你们采取了什么措施?
A: 保持公开和密切的沟通至关重要。从新冠病毒疫情爆发的早期阶段开始,我们预计到将对正在开展的项目造成潜在影响,并通过虚拟会议主动告知客户。与此同时,我们照常举行相关会议,通过电邮进行及时沟通。
在之前的特殊时期,我们设法安排有限的现场人员来维持与细胞培养和生物反应器相关的基本业务运营。我们的科学家们前往实验室参加重要的项目和实验,团队的其他成员则在家中工作。在进入中心前,员工将测量体温并必须佩戴口罩。
为支持当前项目及新项目的正常进行,我们组成了一支由多个职能部门组成的团队,其中包括来自法规管理、采购、进出口和海关服务各个部门的支持,确保客户的物料(如:细胞)安全、及时地运抵。
我们具有稳健的质量体系,我们的质量团队将一如既往地检查和审查项目数据,确保可追溯性和数据完整性。
Q: 您认为在这个特殊阶段取得成功的关键因素是什么?
A: 在我们所采取的措施中,以下两方面对于项目的持续进行以及恢复全面服务至关重要:
●主动与员工和客户沟通相关决策;
●确保员工的健康和安全是我们的首要任务。我们每日监控团队成员及其家庭的健康状况。对于在什么条件下可恢复全面运营,所获得的报告和图表为我们提供了重要的信息。这种关注为我们所做出的决定以及恢复全面服务的时机提供了有利的指导。
新冠疫情无疑为全球带来了前所未有的挑战。作为全球**的科技公司,我们将持续积极地推动患者所需的新药开发和推广,默克上海BioReliance®端到端生物工艺开发中心将继续与客户和合作伙伴一起共同战役,包括大流行病的治疗方法的开发,一如既往地为生物制药行业提供协助。