
Diels-Alder反应(狄尔斯–阿尔德反应)是一种共轭二烯烃和烯烃(亲双烯体)之间形成不饱和六元环的反应。简称D-A反应,又称双烯合成。由于该反应涉及通过环状过渡态形成环状产物,因此也被称为环加成反应。Diels-Alder反应是一种电环反应,涉及共轭二烯的4个π-电子和亲双烯体(烯烃或炔烃)的2个π-电子的[4+2]环加成。该反应涉及新的σ键的形成,其在能量上比π键更稳定。这种反应在有机化学合成上具有重要意义,由两位德国化学家奥托·迪尔斯(Otto Paul Hermann Diels)和他的学生库尔特·阿尔德(Kurt Alder)于1928年发现。他们于1950年被授予诺贝尔化学奖。[1]
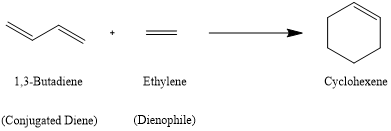
Hetero-Diels–Alder reaction(杂Diels-Alder反应)是该反应的变体,可用于合成六元杂环。在这个反应中,共轭二烯或亲二烯体中含有杂原子。最常见的是氮杂Diels–Alder反应和氧杂Diels–Alder反应。[1]
Diels–Alder反应应用
Diels–Alder反应可应用于以下合成:
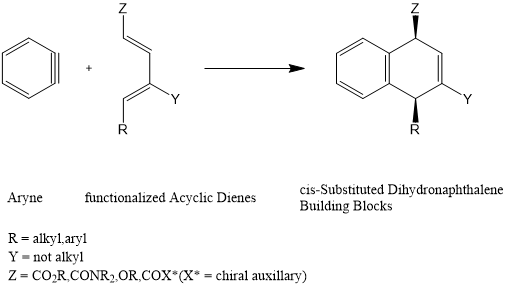
苯炔与官能化无环二烯的新型Diels-Alder反应可用于合成用途广泛顺式取代的二氢萘类分子砌块。[2]
通过Diels-Alder反应合成天然和非天然聚碳环和多杂环化合物。[3]
基于Diels-Alder反应可构建取代(四氢)喹啉和多种N-多杂环化合物,其中包括一些含有吡咯喹啉或五环喹啉的生物碱。[4]
亚氨基Diels-Alder反应(IDA),在无水三氯化铟(InCl3)的催化下,可得到吡喃并[3,2-c]喹啉和茚并[2,1-c]喹诺酮类。[5]
双杂Diels-Alder反应可以优异的产率合成对称取代的1,8-二氮杂-9,10-蒽醌衍生物。[6]
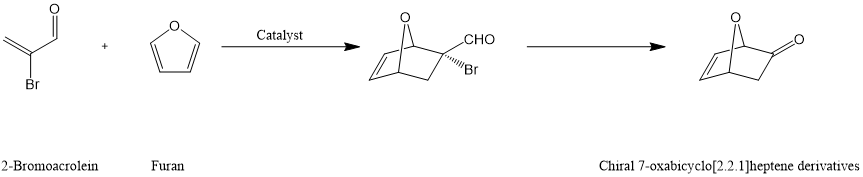
N-甲苯磺酰基(αS,βR)-β-甲基色氨酸衍生的噁唑硼烷可作为2-溴丙烯醛和呋喃对映选择性Diels-Alder反应的催化剂,从而高效合成一系列手性7-噁唑双环[2.2.1]庚烯衍生物。[7]
通过Diels–Alder反应高效、高产的合成溴基、硼基和锡基官能化的1,2-双(三甲基甲硅烷基)苯。1,2-双(三甲基甲硅烷基)苯是合成苯炔前体、路易斯酸催化剂和某些发光体的关键起始材料。[8]
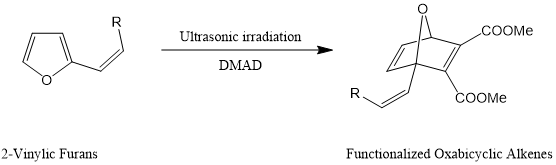
在超声处理条件下,Diels−Alder环加成以高产率提供官能化的氧杂双环烯烃。[9]
Diels–Alder反应研究趋势
研究N-芳基亚胺和各种富电子烯烃的分子内和分子间亚胺Diels–Alder反应(Povarov反应)。[4]
超声波辐射促进了取代呋喃与活性亲二烯烃(如乙炔二羧酸二甲酯(DMAD)和马来酸二甲酯)的Diels–Alder反应,并以良好的产率制备了官能化的氧杂双环烯烃。[9]
基于石墨和四氰基乙烯的Diels-Alder反应,应用于石墨机械剥离高效合成石墨烯加合物。[10]
在不使用催化剂的情况下,使用Diels-Alder“点击”反应在水介质中制备交联水凝胶。[11]
非均相铜(II)-双(恶唑啉)基聚合物固定化离子液相(PIILP)系统催化N-丙烯酰氧唑烷酮和环戊二烯之间的不对称Diels-Alder反应。[12]
手性噁唑硼烷-溴化铝络合物是对映选择性Diels−Alder反应高效潜力催化剂。[13]
卤代环烯酮作为分子间和分子内Diels-Alde环加成中的强效亲二烯物的研究。[14]
化学热力学在C60富勒烯与一系列蒽(蒽、9,10-二甲基蒽、四烯和并五苯)的Diels-Alder反应中的应用。[15]
参考文献
1.Fringuelli F, Taticchi A. 2001. The Diels-Alder Reaction. https://doi.org/10.1002/0470845813
2.Dockendorff C, Sahli S, Olsen M, Milhau L, Lautens M. 2005. Synthesis of Dihydronaphthalenes via Aryne Diels?Alder Reactions: Scope and Diastereoselectivity. J. Am. Chem. Soc.. 127(43):15028-15029. https://doi.org/10.1021/ja055498p
3.Smith MB. 2011. Organic Synthesis.
4.Kouznetsov VV. 2009. Recent synthetic developments in a powerful imino Diels?Alder reaction (Povarov reaction): application to the synthesis of N-polyheterocycles and related alkaloids. Tetrahedron. 65(14):2721-2750. https://doi.org/10.1016/j.tet.2008.12.059
5.Babu G, Perumal PT. 1998. Convenient synthesis of pyrano[3,2-c]quinolines and indeno[2,1-c] quinolines by imino Diels-Alder reactions. Tetrahedron Letters. 39(20):3225-3228. https://doi.org/10.1016/s0040-4039(98)00397-9
6.Pérez JM, López-Alvarado P, Avendaño C, Menéndez J. 2000. Hetero Diels?Alder Reactions of 1-Acetylamino- and 1-Dimethylamino-1-azadienes with Benzoquinones. Tetrahedron. 56(11):1561-1567. https://doi.org/10.1016/s0040-4020(00)00058-2
7.Corey E, Loh T. 1993. Catalytic enantioselective diels-alder addition to furan provides a direct synthetic route to many chiral natural products. Tetrahedron Letters. 34(25):3979-3982. https://doi.org/10.1016/s0040-4039(00)60594-4
8.Reus C, Liu N, Bolte M, Lerner H, Wagner M. 2012. Synthesis of Bromo-, Boryl-, and Stannyl-Functionalized 1,2-Bis(trimethylsilyl)benzenes via Diels?Alder or C?H Activation Reactions. J. Org. Chem.. 77(7):3518-3523. https://doi.org/10.1021/jo3002936
9.Wei K, Gao H, Li WZ. 2004. Facile Synthesis of Oxabicyclic Alkenes by Ultrasonication-Promoted Diels?Alder Cycloaddition of Furano Dienes. J. Org. Chem.. 69(17):5763-5765. https://doi.org/10.1021/jo049210a
10.Ji Z, Chen J, Huang L, Shi G. High-yield production of highly conductive graphene via reversible covalent chemistry. Chem. Commun.. 51(14):2806-2809. https://doi.org/10.1039/c4cc09144b
11.García-Astrain C, Algar I, Gandini A, Eceiza A, Corcuera MÁ, Gabilondo N. 2015. Hydrogel synthesis by aqueous Diels-Alder reaction between furan modified methacrylate and polyetheramine-based bismaleimides. J. Polym. Sci. Part A: Polym. Chem.. 53(5):699-708. https://doi.org/10.1002/pola.27495
12.Doherty S, Knight JG, Ellison JR, Goodrich P, Hall L, Hardacre C, Muldoon MJ, Park S, Ribeiro A, de Castro CAN, et al. An efficient Cu(ii)-bis(oxazoline)-based polymer immobilised ionic liquid phase catalyst for asymmetric carbon?carbon bond formation. Green Chem.. 16(3):1470-1479. https://doi.org/10.1039/c3gc41378k
13.Liu D, Canales E, Corey EJ. 2007. Chiral Oxazaborolidine?Aluminum Bromide Complexes Are Unusually Powerful and Effective Catalysts for Enantioselective Diels?Alder Reactions. J. Am. Chem. Soc.. 129(6):1498-1499. https://doi.org/10.1021/ja068637r
14.Ross AG, Townsend SD, Danishefsky SJ. 2013. Halocycloalkenones as Diels?Alder Dienophiles. Applications to Generating Useful Structural Patterns. J. Org. Chem.. 78(1):204-210. https://doi.org/10.1021/jo302230m
15.Cataldo F, García-Hernández DA, Manchado A. 2015. Chemical Thermodynamics Applied to the Diels?Alder Reaction of C60Fullerene with Polyacenes. Fullerenes, Nanotubes and Carbon Nanostructures. 23(9):760-768. https://doi.org/10.1080/1536383x.2014.997354
阿拉丁提供相关产品,详情请见阿拉丁官网:Diels-Alder Reaction (aladdin-e.com)
