血栓是心肌梗塞、脑卒中、肺栓塞、恶性肿瘤等多种疾病发展过程中血管内重要的病理事件。血栓由胶原、组织因子、凝血酶等因素触发,诱导局部血小板活化、纤维/纤连蛋白复合物形成,这些关键成分共同参与构建包括肿瘤在内多种疾病的血管内微环境。因此,诱导或抑制不同疾病中的血栓组分,是纳米药物血管调控中的关键治疗策略。
国家纳米中心聂广军课题组利用仿生血小板纳米颗粒实现血栓性疾病局部急性血栓的溶栓治疗,相关工作于Advanced Materials上发表(Engineered Nanoplatelets for Targeted Delivery of Plasminogen Activators to Reverse Thrombus in Multiple Mouse Thrombosis Models)。作者针对目前血栓溶栓临床一线用药阿替普酶(rt-PA)出血风险高、治疗时间窗窄、半衰期短的三个核心问题,提出利用血小板膜纳米颗粒搭载溶栓药物的策略。这种策略使得纳米药物制备简便,并在小鼠脑卒中、肺栓塞、肠系膜血栓三个血栓性疾病模型上显示出广谱的优化溶栓治疗效果。
基本信息
题目:
Engineered Nanoplatelets for Targeted Delivery of Plasminogen Activators to Reverse Thrombus in Multiple Mouse Thrombosis Models
期刊:Advanced Materials
影响因子:27.398
PMID:31788896
第一作者:徐俊超
通讯作者:
聂广军研究员、李素萍研究员与张银龙博士
合作单位:
国家纳米科学中心,首都医科大学附属天坛医院、中国药科大学、苏州大学附属第一医院
索莱宝合作产品:
BC1375:Total Sulfhydryl(Mercapto)Assay Kit
C0030:Hoechst 33342
C0030:RIPA
研究背景及摘要
血栓性事件,即心血管相关疾病、缺血性中风和肺栓塞(PE),是世界范围内发病率和死亡率的主要因素。在血栓部位,急性血管阻塞可导致严重的组织损伤甚至器官衰竭,最终成为生命威胁。为了在紧急情况下实现血栓的快速清除和闭塞血管的再通,外科手术和溶栓治疗通常是最有效的治疗方法。由于外科手术的费用和侵袭性,溶栓药物的应用,特别是FDA唯一批准的缺血性卒中溶栓药物重组组织纤溶酶原激活剂(rt-PA)的应用,仍然是治疗血栓相关疾病最重要的选择。Rt-PA是血栓溶解的主要酶。这种酶催化血液纤溶酶原转化为纤溶酶,进一步降解血栓的纤维网。虽然溶栓治疗已被广泛采用,但全身给药会造成凝血因子的滥用,从而产生高风险的不良出血并发症,如颅内出血。此外,大多数溶栓药物半衰期短,需要在短时间内重复用药,这会带来额外的风险。考虑到这些风险,临床指南通常建议在症状出现后3-12小时内应用溶栓治疗。超过这个治疗时间窗(TTW),溶栓的益处将不再大于造成的出血风险。为了改善患者的预后,迫切需要针对性地将溶栓药物输送到局部血栓,以减少全身副作用,延长溶栓药物的半衰期。
目前的溶栓策略由于治疗药物的半衰期短、靶向能力低和意外出血并发症,而使得治疗效果十分局限。受血小板在止血和病理血栓中的先天作用的启发,作者开发了血小板膜伪装聚合物纳米粒子(纳米血小板),用于将溶栓药物重组组织纤溶酶原激活剂(rt-PA)靶向递送到局部血栓部位。量身定制的纳米血小板可以有效地积聚在肺栓塞和肠系膜动脉血栓形成模型小鼠的血栓中,与游离rt-PA相比,溶栓活性显著增强。此外,纳米血小板在缺血性脑卒模型中表现出比游离rt-PA更好的治疗效果。体内凝血指标分析表明,纳米血小板具有较低的出血并发症风险。作者所开发的复合仿生纳米血小板为在血栓形成疾病中提高溶栓治疗的疗效和降低出血风险提供了一种有前途的解决方案,对改善血栓治疗的现状具有巨大的潜力。
研究内容及结果
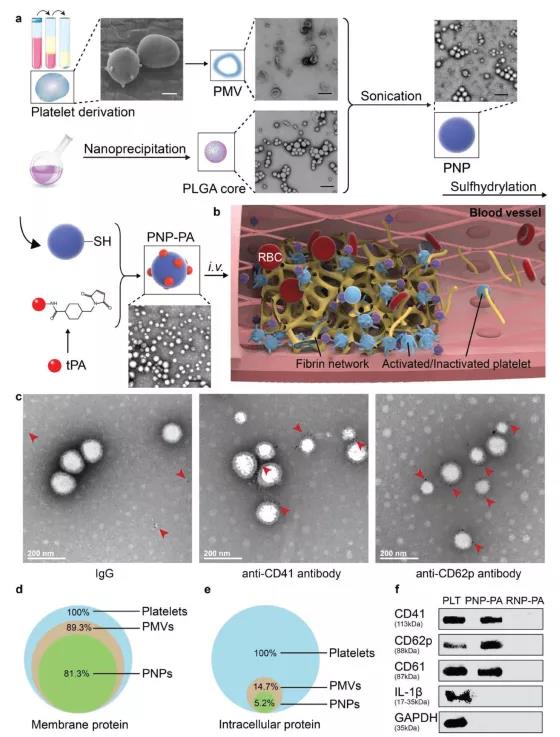
1. PNP-PA纳米颗粒的制备及其表征
作者将血小板膜泡聚合物纳米粒(PNP)与rt-PA(在下文中简称为“tPA”)结合,以实现血栓靶向溶栓治疗(指定为PNP-PA;图1a)。简单地说,从小鼠全血中获得的血小板膜被用来覆盖PLGA核的外部。随后,rt-PA通过-SH基团结合到血小板膜表面,形成PNP-PA(PMV,PMVs)。结果表明PNP-PA纳米颗粒能够在各种环境中成功合成,并且具有高稳定性。当静脉注射到几种不同的血栓动物模型中时,包括肠系膜动脉栓塞、PE和缺血性中风,PNP-PA均表现出强大的天然靶向性和局部血栓降解性能,表明该制剂在血栓相关疾病中具有广泛的治疗潜力(图1b)。此外,安全性评估显示由于PNP-PA为非系统性纤溶状态而表现出比游离rt-PA更低的出血风险。这种仿生溶栓纳米血小板为治疗血栓相关疾病提供了一种安全实用的策略,并且引起出血并发症的风险较低。采用血小板特异性标记物CD41和CD61对PNP-PA的表面免疫染色进一步说明了具有理想涂层取向的血小板膜的成功转移(图1c)。为了验证合成过程是否影响膜蛋白的完整性,作者在基因本体注释的基础上,进行了蛋白质组学分析,对属于不同细胞组分的蛋白质数量进行了分类。分析结果表明在制备PNP-PA过程中,高达81.3%的膜蛋白被保存(图1d)而94.8%的细胞内蛋白质被去除(图1e)。为了进一步证实功能膜蛋白在PNP-PA上的保留,作者进行了Western-blot分析。结果表明PNP-PA具有的主要膜粘附相关蛋白包括CD41、CD62p和CD61(图1f)。
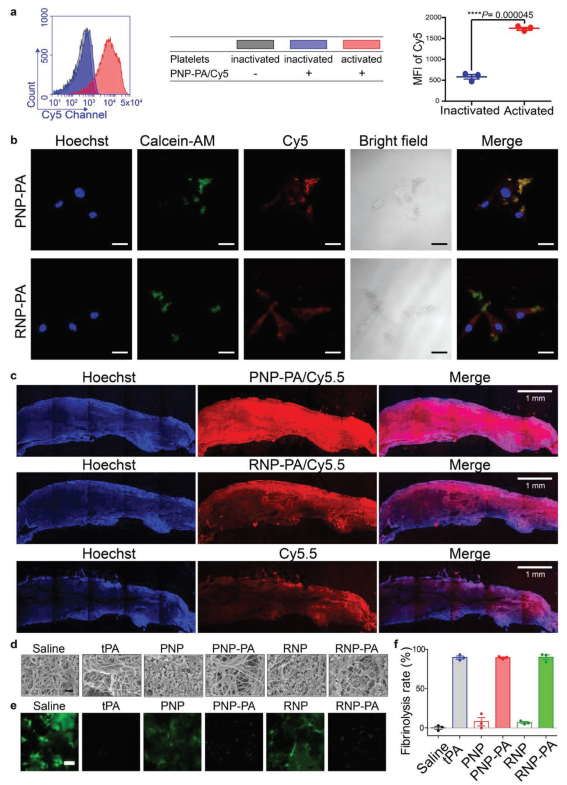
2. PNP-PA的体外靶向性和溶栓作用
活化血小板是血栓形成的主要成分之一,尤其是在血栓形成的早期。作者采用流式细胞术分析PNP-PA与活化血小板结合。在流式细胞术实验中,荧光标记的PNP-PA优先结合活化血小板(图2a)。尽管PNP-PA与活化血小板结合,但PNP-PA本身并没有显示出任何活化血小板的能力。虽然活化血小板已被证实在使PNP-PA聚集在血栓形成部位过程中起关键作用,但活化血小板聚集分子的机制尚不清楚。作者认为,这可能是由于PNP-PA通过血小板膜上的多种特异性受体与血栓相互作用的结果。因此,PNP-PA能够靶向血栓形成部位,进而实现rt-PA的功能。接下来,作者用激光扫描共聚焦显微镜评估了PNP-PA与血小板的结合能力。粘附的人脐静脉内皮细胞(HUVECs)首先与纯血小板孵育以模拟血管内环境中的血栓形成。然后,加入Cy5标记的PNP-PA或红细胞膜包裹的纳米颗粒(RNP-PA)并与血小板结合的HUVECs孵育。如图2b所示,与RNP-PA组(Rr=0.378)相比,PNP-PA组显示出更强的荧光强度和更高的血小板信号重叠共效率(Rr=0.866)。图2c显示,与Cy5.5标记的RNP-PA和游离Cy5.5相比,Cy5.5标记的PNP-PA能更有效地结合在患者血栓样本上。以上实验结果均表明,PNP-PA可以靶向血小板丰富的血栓。扫描电镜观察到PNP-PA在纤维蛋白网络上的滞留,也表明PNP-PA在体外明显粘附在富含血小板的血栓上(图2d)。重要的是,凝块密度和纤维蛋白的降低显示了PNP-PA的溶栓作用(图2d)。最后用共聚焦显微镜观察PNP-PA的体外纤溶能力。绿色荧光标记的纤维蛋白网络与生理盐水、rt-PA、PNP、rt-PA、PNP-PA或RNP和RNP-PA孵育。图2e,f中的荧光图像和定量分析均显示rt-PA、RNP-PA和PNP-PA均能在体外显著降解富含纤维蛋白的血栓。
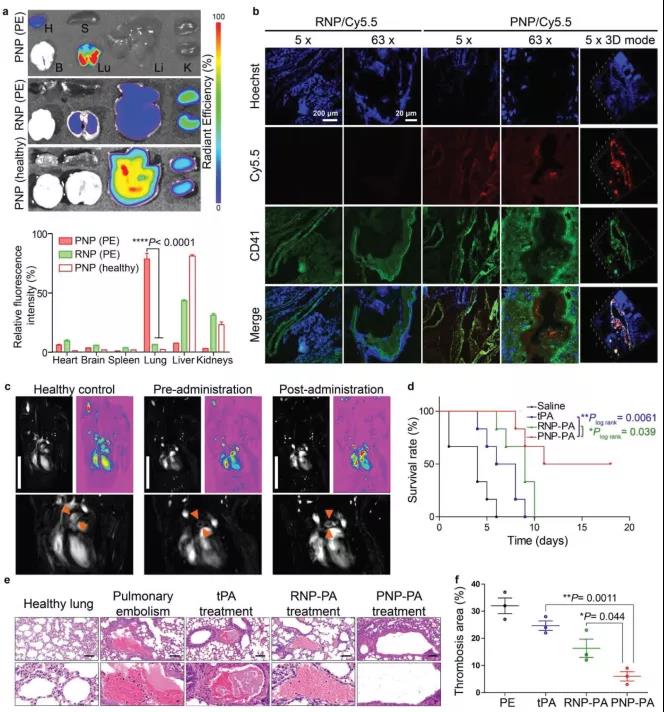
3. PNP-PA对PE小鼠模型的治疗作用
急性肺栓塞(PE)是静脉血栓栓塞后出现的的一种严重并发症,死亡率高,30天生存率低于30%。在凝血酶诱导的PE小鼠模型中,作者观察了PNP-PA对PE的治疗作用。小鼠注射凝血酶30min后立即尾静脉注射Cy5.5标记的PNP-PA或RNP-PA诱发PE。健康小鼠注射Cy5.5标记的PNP-PA作为阴性对照。两小时后处死小鼠,采集心、肝、脾、肺、肾进行荧光成像。图3a所示的结果表明,成功建立了PE模型,并且与RNP-PA相比,PNP-PA在PE小鼠肺中选择性聚集。使用共焦显微镜观察了肺冷冻切片中的PNP-PA信号。用血小板表面特异性标记CD41免疫荧光染色法观察肺血栓内血小板。PNP-PA的荧光信号与CD41强共定位表明PNP-PA的血栓靶向性是由血小板膜相互作用介导的(图3b),然后使用磁共振成像(MRI)评估血栓抢救实验中肺动脉的血流,正常小鼠肺动脉血流信号强,颈静脉注射凝血酶后,血流信号明显降低。然而,注射凝血酶后静脉注射PNP-PA,信号几乎完全恢复,表明PNP-PA有可能有效逆转血栓栓塞(图3c)。作者还评估了注射不同药物制剂后PE小鼠的存活率。血栓诱导后,生理盐水组的所有小鼠在6天内死亡,而游离rt-PA治疗后将中位生存时间从4天提高到7天。值得注意的是,PNP-PA治疗将中位生存时间进一步提高到14.5天(图3d)。H&E染色显示肺组织的血栓形成区结果也表明PNP-PA比游离rt-PA更有效地溶解血栓(图3e,f)。
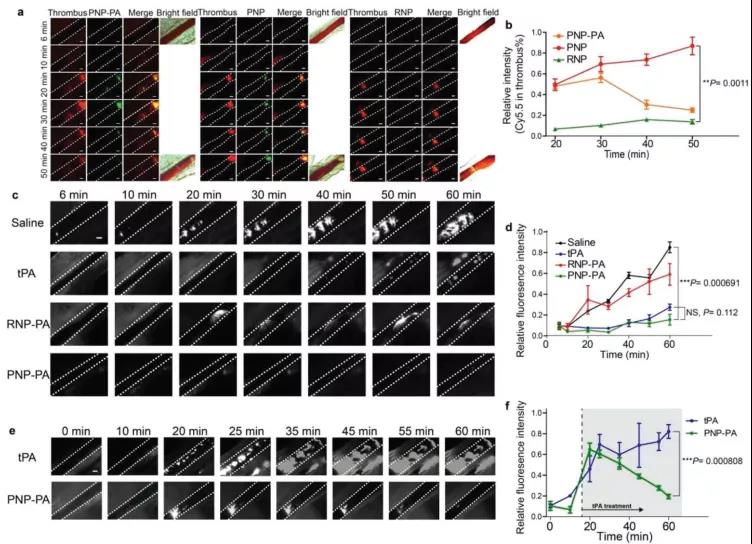
4. PNP-PA对肠系膜动脉血栓小鼠模型的治疗作用
为了进一步验证PNP-PA的血凝块溶解潜能,作者建立了FeCl3诱导的血管内皮细胞损伤直接触发的肠系膜动脉血栓小鼠模型。在FeCl3孵育之前,Rho6G标记的血小板静脉注射到C57BL/6J小鼠体内,以观察血栓。接下来,作者用荧光显微镜记录血栓形成的动态过程。孵育20分钟后,血栓完全形成。实时荧光显微镜分析表明,与RNP-PA治疗组相比,PNP-PA和PNP对血栓的靶向性更强(图4a,b)。但PNP-PA的荧光信号随时间显著降低,这可能与其纤溶功能有关。相反,RNP-PA组几乎没有荧光NP信号。接下来,作者比较了rt-PA、RNP-PA和PNP-PA组成的不同药物制剂在肠系膜动脉血栓形成模型中的治疗效果。当这些药物在血栓完全形成前注射到小鼠体内时,rt-PA和PNP-PA能够推迟血栓形成的过程(图4c,d),而在血栓完全形成过程中显示出的作用是有限的,这与以前的报道一致。然而,如果这些药物在FeCl3诱导血栓形成后作为延迟治疗使用,当血栓完全形成时,只有PNP-PA治疗能有效清除血栓;游离rt-PA没有显示任何明显的治疗效果(图4e,f)。
5. PNP-PA对缺血性脑卒中小鼠模型的治疗作用
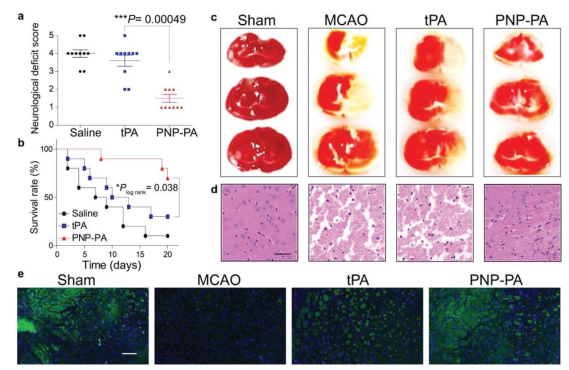
静脉注射组织型纤溶酶原激活剂(rt-PA)是FDA唯一批准的急性缺血性卒中溶栓治疗方法。尽管新疗法可能在一定程度上有助于减轻缺血性中风的长期副作用,但是患者从这些新一代疗法中获得的紧急益处仍然受到先前溶栓药物的缺点的限制,即:半衰期极短、治疗窗口窄、靶向性低,以及异常出血现象。作者为了探讨纳米血小板能否克服这些障碍,建立了短暂性大脑中动脉闭塞(MCAO)的栓塞模型。将MCAO小鼠随机分为三组,分别静脉注射生理盐水、rt-PA或PNP-PA,另一组对照小鼠进行假MCAO手术。最后治疗后,对小鼠进行神经功能缺损评估,以评估脑损伤程度。与生理盐水组和rt-PA组相比,PNP-PA治疗组的评分明显较低,表明脑损伤较弱(图5a)。在观察的20天内,rt-PA治疗使MCAO小鼠的存活率增加了20%左右,而PNP-PA治疗使MCAO小鼠的存活率增加到70%(图5b)。用2,3,5-三苯基四氮唑(TTC)染色观察治疗后脑组织坏死区。PNP-PA组治疗的MCAO小鼠的缺血面积明显小于生理盐水组或游离rt-PA组(图5c)。缺血区的组织学检查也显示了同样的现象(图5d);生理盐水和游离rt-PA组出现了相当大的坏死,但PNP-PA组小鼠没有。已知游离rt-PA通过多种途径损伤血脑屏障(BBB),进而引起神经毒性。免疫荧光染色结果显示PNP-PA具有明显的神经保护作用,如图5e所示。
6. PNP-PA的药代动力学及安全性评价
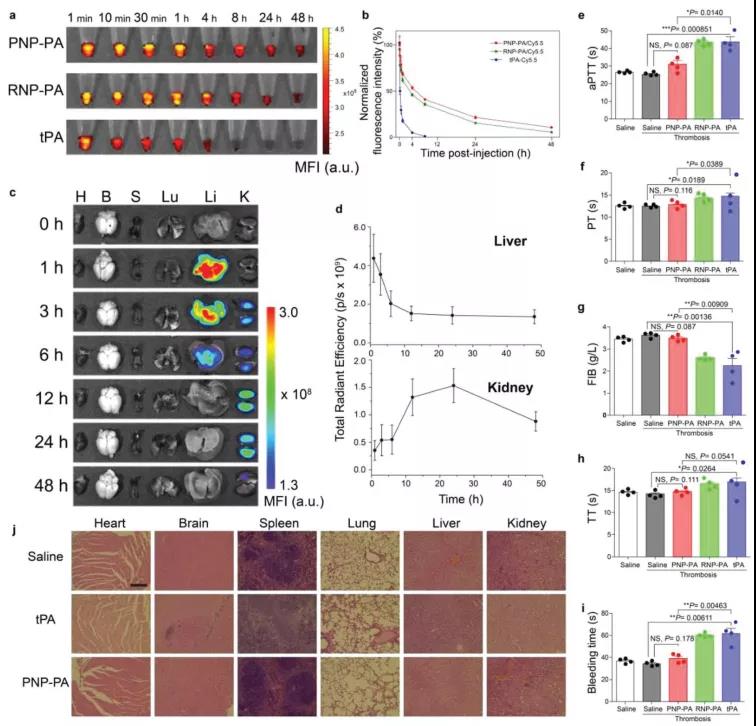
用Cy5.5标记的PNP-PA、RNP-PA或游离rt-PA对C57BL/6J小鼠进行体内实验。在不同时间间隔采血,在荧光成像系统中检测荧光强度。血浆药代动力学参数如图6a、b所示。PNP-PA、RNP-PA和游离rt-PA的半衰期分别为13.26、10.45和1.12 h,而药物浓度-时间曲线的AUC(曲线下面积)分别为28.29、22.36和2.73,进一步证明仿生涂层延长了rt-PA的循环半衰期,并通过不同时间间隔的荧光成像检测了Cy5.5标记的PNP-PA在器官中的分布。随着时间的推移,肝脏荧光迅速降低,而肾脏荧光在最初的12小时内升高,然后在24小时后降低,反映了肝脏降解和肾脏消除的药代动力学曲线。重要的是,在心脏、脾脏或肺中几乎没有观察到荧光(图6c、d),表明在其他主要器官中几乎没有潜在的副作用。最后,作者对PNP-PA进行了体外和体内安全性评价。作者首先使用两种非肿瘤内皮细胞系HUVECs和脑毛细血管内皮细胞(bEnd.3)研究了该制剂的体外细胞毒性。用PNP-PA处理后,即使在最大浓度20000 mg/L,HUVECs或bEnd.3均未观察到明显的细胞毒性。在体内,PNP-PA治疗后的凝血参数、活化部分凝血活酶时间、纤维蛋白原时间、凝血酶原时间、凝血酶时间和出血时间与生理盐水组相比无显著性差异,游离rt-PA和RNP-PA治疗导致这些参数的显著变化,表明出血的风险很高(图6e-i)。接下来,作者通过H&E染色研究了PNP-PA对心脏、肝脏、脾脏、肺和肾脏等主要器官组织病理学的影响,如图6j所示,没有明显的病理变化。
研究结论
在本研究中,作者开发出一种新型的血小板膜修饰的纳米粒子。PNP-PA能选择性靶向血
