PBMC(peripheral blood mononuclear cell),外周血单个核细胞,其主要细胞类型为血液里具有单个核的细胞,主要包括淋巴细胞(T\B),单核细胞,吞噬细胞,树突状细胞和其他少量细胞类型,其中淋巴细胞占很大一部分。分离PBMC的主要目的是为了将多核细胞和红细胞去除,从而能够很方便地模拟体外的血液免疫环境。从血液制备PBMC是分离特定免疫细胞亚群之前常见的一个步骤。最常用的PBMC分选方法是使用密度梯度离心液进行离心。
工具/原料
全血 (以10ml为例)
无菌PBS溶液(pH7.4) 或者生理盐水
蔗糖溶液(Ficoll Pague PLUS)
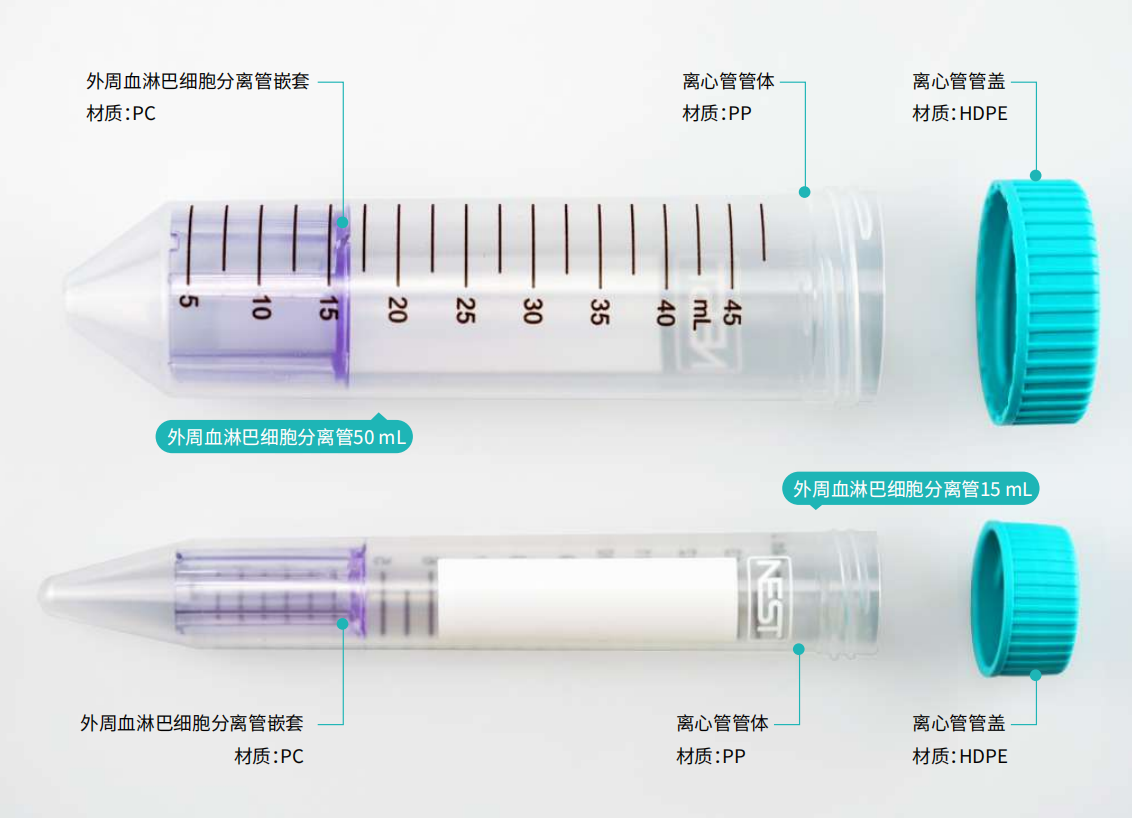
外周血淋巴细胞分离管
方法/步骤
1. 将分离液用移液管从分离管嵌套的中心孔中加入:15ml的分离管需要加入约4ml分离液;50ml的分离管需要加入约13ml分离液,确保分离液覆盖嵌套上方。
2. 将抗凝样本沿管壁缓慢倒入或用移液管沿管壁缓慢加入到分离管中。
3. 室温下离心10min,离心力为1200 x g。
4. 收获PBMC细胞,将分离管中上清倒入另一干净离心管中,分离管中的嵌套能有效避免红细胞和粒细胞再次污染。(注意:离心后倾倒收获细胞前,也可先吸取采集或丢弃最上层血浆层,有助于减少细胞被血小板污染。)
5. 用PBS洗涤PBMC细胞,在250 x g离心力下离心10min。
6. 按步骤5重复洗涤2次,用5ml PBS缓冲液重悬细胞。
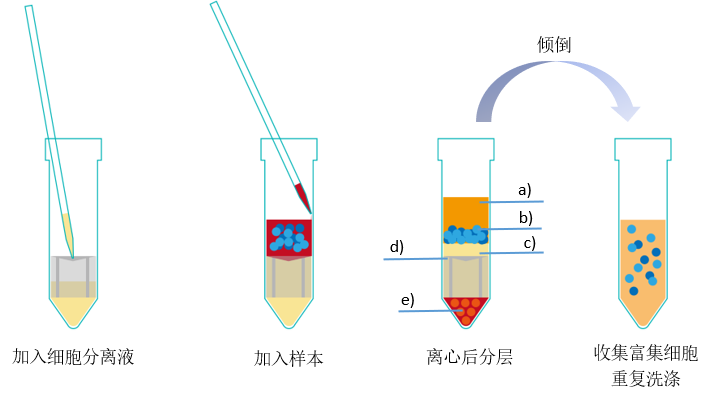
离心后液体分离情况(从上到下):a血浆层;b富集的细胞部分(PBMCs);c分离液;d嵌套;e沉淀(红细胞和粒细胞)。
注意事项
1. 可用于人类外周血、骨髓和脐带血样本。不适用于血凝等异常样本或超过48小时的样本。
2. 15ml的分离管建议使用4-9ml样本;50ml的分离管建议使用13-30ml样本。
3. 对于放置24h以上的样本,建议离心时间加长。
4. 离心后收获细胞前,也可先吸取采集或丢弃最上层血浆层,有助于防止被血小板污染。
5. 离心后倾倒上清时不要将分离管倒置2s以上。
6. 分离管请勿重复使用。
7. 离心后,细胞可能聚集在富集层以上的分离管的管壁上。这种聚合是正常的,受样本质量、样本放置时间和抗凝剂类型的影响。此聚合与分离管的使用无关。细胞可以通过使用移液管尖端轻刮聚集团的一侧来清除。
