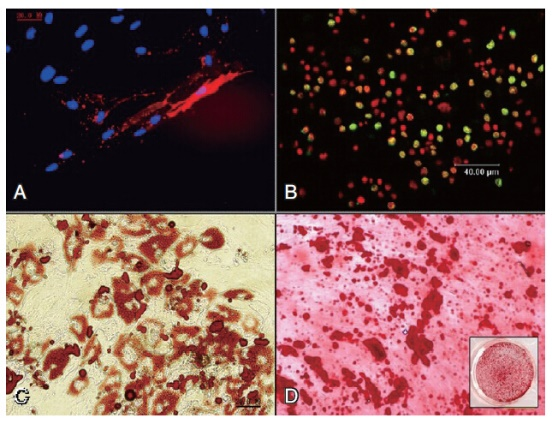
干细胞诱导成骨实验
间充质干细胞属于成体干细胞,可在体外通过不同的方法干预下下诱导分化为骨、软骨及其他结缔组织,因其来源广泛,分离无创伤,较低的免疫原性、生长周期短等特点,是组织工程种子细胞的重要来源。
干细胞的诱导分化一方面是干细胞鉴定的主要方法,另一方面也是干细胞功能学研究的主要途径。采用体外条件培养基诱导培养下,人间充质干细胞应能够分化为成脂肪、骨、软骨细胞。成骨分化经茜素红染色鉴定。
实验前准备
试剂:PBS,成骨诱导分化培养基,茜素红
耗材:NEST细胞培养皿,NEST普通吸头,NEST微量离心管
设备:CO2培养箱,显微镜
一、接种骨髓间充质干细胞
取对数生长期的细胞,按照2×105cells/cm2的细胞密度接种至包被后的细胞培养皿中,将接种好的细胞培养皿放到37℃,5% CO2细胞培养箱培养,定期观察细胞增殖状态,当细胞融合度达60-70%时,弃掉上清,加入成骨诱导分化培养基。

二、细胞分化诱导
每2-3天进行换液(定期观察是否有污染),再放入37℃,5% CO2细胞培养箱中培养约2-3周,并注意观察细胞形态变化。根据细胞钙盐结晶析出和钙质结节形成的情况,决定终止细胞诱导的时间,进行下一步染色鉴定。

三、细胞固定
用吸头(确保吸取充分)吸去培养基使用适量1×PBS清洗一次,弃去后取适量4%中性HCHO溶液细胞培养皿底面,室温固30-60min,弃去固定液再使用1×PBS清洗两次。

四、茜素红染色
加入适量茜素红染液染3-5min,吸去茜素红染液,用1×PBS清洗两次,并加入适量1×PBS避免细胞干燥。
五、诱导评估
显微镜下观察成骨染色效果,并进行图像采集和诱导评估。诱导成功时,钙质结节会与茜素红染料结合后呈现红色或橘红色。