摇瓶培养技术问世后,由于其简便、实用,很快便被发展成为微生物培养中极重要的技术而普及,并广泛用于工业微生物菌种筛选、实验室大规模发酵试验、种子培养等。
Question 1:摇瓶的培养设备有哪些?
NEST:根据震荡方式分类,摇瓶培养设备主要有旋转式摇床和往复式摇床两种类型,也有旋转式和往复式的混合类型, 其中以旋转式最为常用。

NEST 耐CO2水平摇床

NEST 试管旋转混匀器
用旋转式摇床进行微生物振荡培养时,固定在摇床上的三角烧瓶随摇床以 200~250r/min 的速度运动,由此带动培养物围绕着三角烧瓶的内壁平稳地运动。
振荡培养中所使用的发酵容器通常为三角烧瓶,也有使用特殊类型的烧瓶或试管。在振荡培养过程中所采用的烧瓶类型和振荡类型主要取决于所要研究的发酵类型及性质。
振荡培养通常用于有氧过程中,主要是两种类型:
(1) 供氧相对较大,以产生大量的细胞,常见于丝状微生物 (如食用菌、放线菌) 中;
(2) 需供氧但所需供氧量较小,常见于细菌。要获得高氧供应,可在较大的烧瓶 (250~500 ml 三角烧瓶) 中盛装相对较小容积的培养基,由此可获得更高的氧传递速率,便于细胞的迅速生长,要获得较低的氧供, 则采用较慢的振荡速度和相对大的培养体积。

PC锥形摇瓶&高效摇瓶

耐思的高效摇瓶,在传统摇瓶的基础上做了改进,对摇瓶底部优化,节约了占用空间,大大提高了摇床的使用率,降低了客户研发、生产成本。
可用于悬浮细胞或者细菌培养,也可用于培养基配制、混合及储存。
Question 2:摇瓶的培养设备有哪些?
NEST:在摇床、摇瓶的选择等方面都要根据实际情况确认。
摇瓶培养的机械装置主要由用于放置和固定烧瓶的平台以及牵引其运转的马达和运转系统组成,摇瓶需安装于有维持恒温和恒湿自动调节能力的隔热室内。目前也有具备恒温装置的小型台式摇床。考察摇床的设计和使用性能主要从下列几项入手:
1、所使用的设备
2、平衡要求
3、摇床的大小、型号
4、培养条件及恒温调控
5、试管或小型发酵器的振荡培养性能。
通常,摇床的工作温度为 25~37℃。由于电机和机械传动部分的产热、振荡产热和微生物生长代谢释放的热能,使摇瓶中培养基的实际温度要比实际室温高 2℃ 左右,且在强烈振荡时,此温差更为明显。因此, 在实验过程中设计高温点时必须认真注意到这一问题。
另外,由于夏季气温偏高,温控困难随之增大。培养放线菌和真菌时温控更为主要,因为大部分放线菌和真菌在 30℃ 下培养时,其代谢已被严重干扰,而 30℃ 的温度在摇瓶中是极易形成的。因此, 在摇床室中必须装配一个可靠的致冷系统。一般台式摇床都有一通过空气循环或水浴来保持恒温的装置,可使所有的摇瓶内培养基温度处于同一水平。
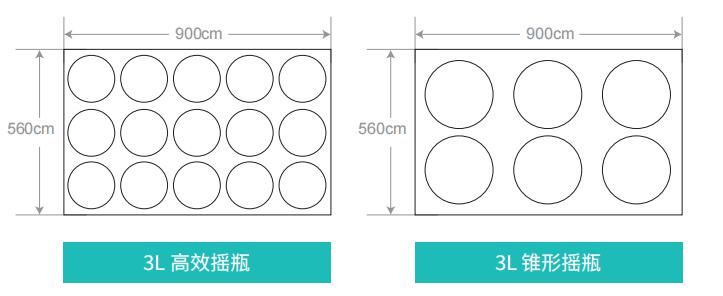
摇瓶盖子类型上除了有常规的密封盖和透气盖,还专门为高效摇瓶设计了各种转移盖。透气盖保证了气体的交换,而特殊的转移盖,降低了在液体转移及培养过程中的污染风险。
倒置转移盖同2L3L5L摇瓶配合使用,将进液管路与所需设备进行连接
需要转移液体时,将摇瓶倒置,通过重力来进行液体转移

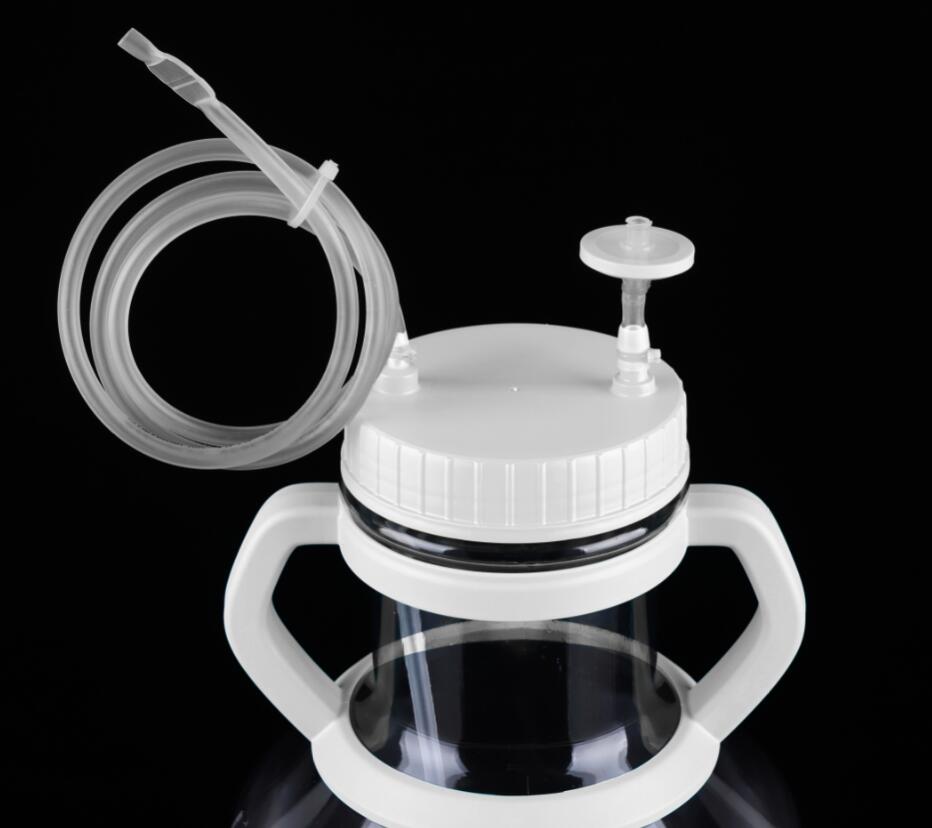
双向液体转移盖:
同2L、3L、5L摇瓶配合使用,将进液管路与所需设备进行连接,
在摇瓶以及设备之间连上蠕动泵即可实现液体转移操作,液体转移完,可换上透气盖进行培养。
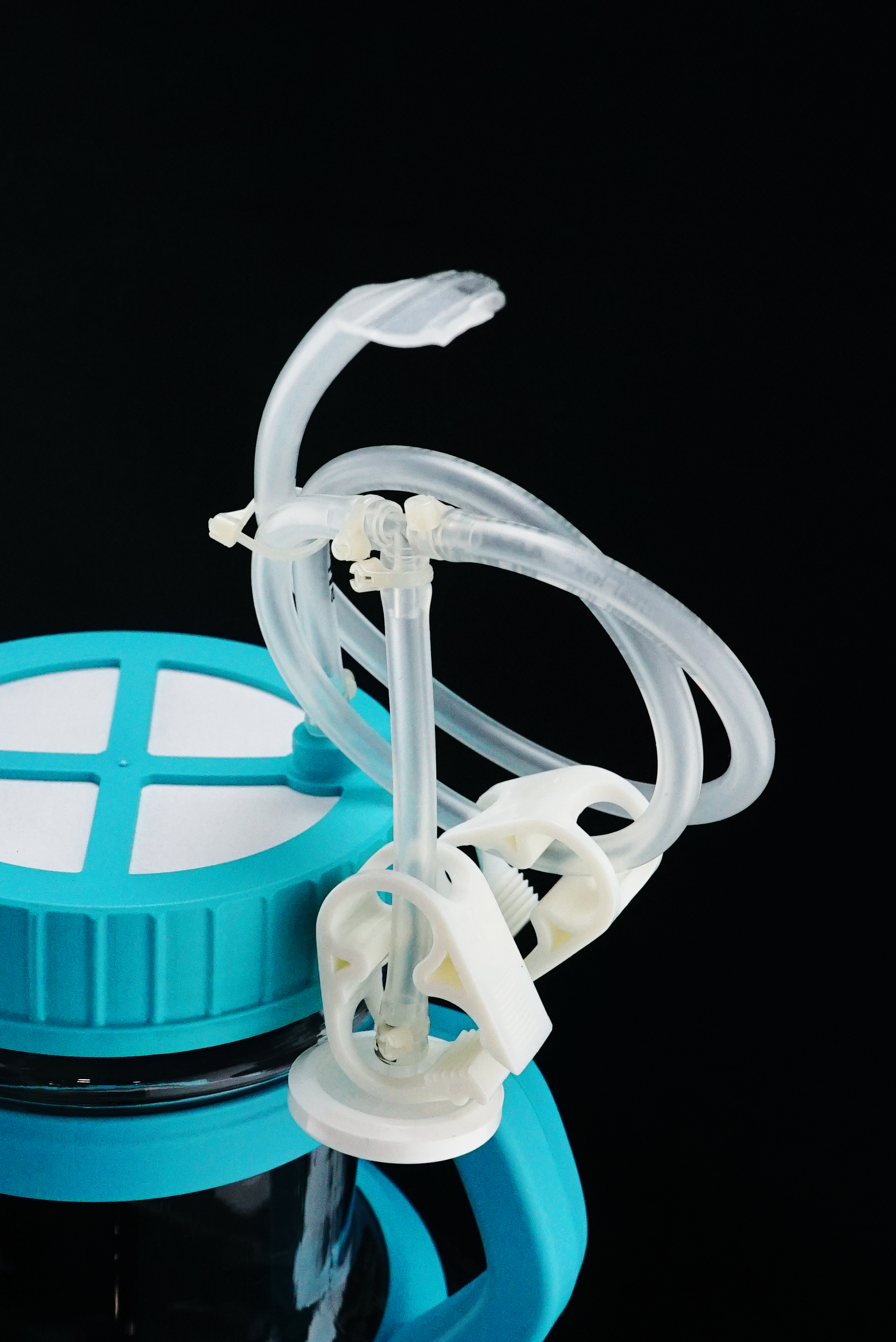
多功能液体转移盖:
多功能转移盖在液体转移完之后,可以直接放入培养箱培养,能够满足较大的空气通量,
取样部件由取样头与单向阀组成,防止取样过程中液体逆流,保证了无菌取样。
进液管路自带PTFE针式滤器,解决了补料过程中管路液体残留的情况。

还可以直接选择自带管路的5L高效摇瓶,省去管路设计、组装、灭菌等操作,提高了生产效率。

Question 3:摇瓶的培养设备有哪些?
NEST:下面我们就讲一下常见问题。
就一特定微生物而言,振荡培养时存在最佳培养基配方和最佳培养基容量。一般来说,振荡培养丝状微生物时培养基最佳容量为50~100ml/500ml三角烧瓶,或25~50 ml/250ml三角烧瓶,即为所使用的发酵容器容积的10~20%。
在这一范围内,所使用培养基量越小,所得试验结果越好。通过使用带有挡板的烧瓶、使用气体通透性更好的封口胶代替纱布或棉塞, 以及增加摇床振荡速率也可获得相同的效应。
但需特别注意的是提高振荡速率时必须注意烧瓶的放置位置与重力平衡,以减少由于角速度增加引起的磨耗和不平衡甚至翻车。如果使用棉塞和纱布时应采用普通棉纱而非脱脂棉纱,以防吸水潮湿而妨碍氧的扩散。
将经接种的烧瓶固定到摇床上培养,在培养过程中应特别注意两个问题:一是上文已提及的温度控制,另一个十分重要的问题就是维持连续振荡。
振荡不连续进行那怕只是数分钟的停顿,对结果的影响都是极显著的;而且由于数分钟的停顿对微生物细胞生长的影响不明显,使影响从表面上不易被发现。有报道在用黑曲霉素生产柠檬酸的发酵试验中,提高通气率可以刺激柠檬酸的生产,中断通气时柠檬酸的产生直线下降,甚至不可逆转。在繁殖期中断通气 20 min 不会使菌株的活力下降,但菌株生产和积累柠檬酸的能力受到不可逆的破坏或减慢。
经 24~48 h 培养,可对烧瓶进行检查,以判断生长的程度和类型。在好氧生长时,消耗1g葡萄糖通常可增加0.25~0.5g的细胞。单细胞性细菌经培养后会出现一稠密或轻度稠密的培养物;而丝状菌株如在含 5% 的糖的培养基中生长可形成密细胞培养物,4~5 天后, 细胞密度可达20~30g/L,如果培养物产生毒性物质或大量的副产物以及产生抑制细菌生长的产物,则其生长速度相应降低。
振荡培养过程中,必须定期定时分析培养过程中的各种参数。通过光密度、培养基中细胞沉积或通过过滤、干燥和称重可定量或半定量地估计细胞生长情况。迅速而粗略地估计细胞生长的方法是将一些培养物放置于一小的测量瓶中,室温静置一段时间后根据细胞沉积粗略估计微生物细胞生长情况。此外,培养液的 pH、残糖、色质、表观和气味的变化也应随时加以记录;用显微镜检测菌丝末端状态、分枝情况、絮凝体形成及污染情况,对于掌握培养物的培养状况也是重要的。
细胞或孢子接种浓度对试验的成功极为重要,不同的微生物细胞或孢子以及不同的振荡培养过程的接种浓度差异可以是十分显著的, 且各自存在一最适浓度。此必须在预试验中确定。最适接种浓度的获得和使用可保证良好的生长和高质量的培养物的获得。使用不同的接种浓度还可获得不同的生产类型。例如,当使用 2×102~1×103/ml 青霉孢子接种浓度时,经 25℃ 培养 120 h 后菌丝呈平滑、致密沉积体;而当接种浓度在 5×103~5×104/ml 时,相同条件下培养后则呈小、纤丝状、絮凝物,直径在 0.4 mm 左右。
振荡培养中最常出现的另一问题是贫脊生长。这通常是由于接种浓度太低或种子活力较差。经验而言, 种子的培养时间为 1~2 天,接种后培养基中的孢子浓度在 5×104~1×106/ml。
振荡培养时培养物被污染并不常见,但一旦被污染,会带来许多麻烦。出现污染时,培养物表面为表观改变,气味异常,菌丝体雾浊不清,产品丢失等,需及时发现并及时处理。
Tip:方法仅供参考,操作中请按实际情况进行调整。
